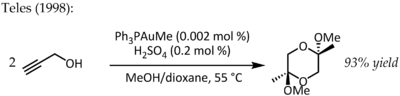有机金化学
在化學中,有機金化學,是一門專門研究包含碳-金鍵的化合物(有機金化合物)的學科,是有機金屬化學的分支。有機金化合物在學術界中得到研究,但在其他方面尚未得到廣泛使用。有機金化合物中常見的氧化數為:配位數為2、有著直綫型分子構型的+1,和配位數為4、有著平面正方形分子構型的+3[1][2][3]。
金(I)配合物
[编辑]金(I)配合物通常配位數為2,是14電子配合物,帶抗磁性,有著直綫型分子構型[1][2][3] 。它們通常以LAuR與三苯膦基、異氰酸根等配體L的加合物的形式而存在,以上的配體可防止一價金因有機殘基二聚而還原成金屬金。金 (I) 也可以金酸鹽(酸根型錯合物)的形式存在。跟Hg(Me)2 和 Pd(Me)22+等其他 M(d10) 配合物一樣,AuR2−負離子的構型為直綫型。傳統上,製備 LAuR 化合物方法是讓格氏試劑與鹵化金(I)發生反應,再與有機鋰化合物(R-Li)反應生成酸根型錯合物。
在一種特殊的化合物中,芳基碳原子橋接兩個金原子。其中一個例子,(2,4,6-三甲苯)金,可以由氯羰基金(I)(Au(CO)Cl)和均三甲苯基的格氏试剂反應而成。碳與金的配位數最高可達到 6。C(AuL)4 類的化合物與甲烷等瓣相似,而C(AuL)5+ 類的化合物與甲烷正離子等瓣相似。這些配位數非常高的配合物可以由閉殼的中心金原子之間的親金作用而穩定[4]。
金氰基配合物(MAu(CN)2)對黃金氰化法有一定的重要性。黃金氰化法是一個由劣質礦提取金的方法。在一般金屬氰化物中,碳-金屬鍵通常為離子鍵,但在金氰基配合中,碳-金鍵為共價鍵[5]。
金(III)配合物
[编辑]金 (III) 配合物通常為16電子化合物,配位數為4、分子構型為平面正方形,具有抗磁性且有毒。當配位數小於4時,可以通過氯等橋連配體或分子內螯合來彌補。一般來說,金(III)化合物是有毒的,因此比起金(I)的化合物,比較少研究金(III)化合物。但是,在金(III)化合物之中,單芳基金 (III) 配合物是經過充分研究的。它們可以通過 AuCl3 對芳烴的親電金化製備而成。
金催化劑
[编辑]金催化反應分為兩大類:第一類為異相催化,例子包括金納米顆粒(例如 Au/TiO2)、金表面的硫醇單層,以及氧化鋁載體上的催化劑,這包括氧化鋁負載的 Au/CeO2。以上的金催化劑已對工業上重要的過程,例如醇的氧化、一氧化碳的氧化以及各種選擇性的加氫反應(例如丁二烯轉化為丁烯)等進行了研究。雖然金催化劑通常顯得有效,並且能夠表現出有用或獨特的選擇性,然而各種異相金催化劑的催化機理也存在相當大的不確定性。
而第二類為均相催化。它使用簡單一價或三價金化合物,這些化合物溶於有機溶劑,可以應用在精細化學品的合成[6][7]。氯化金(I)、氯化金(III)和氯金酸等簡單的化合物或配合物,已被應用。然而,以上的金源很快就會在溶液中產生容易失去活性的催化劑,失活的途徑多爲還原成零價金。對於有機金化合物的均相催化,其中一個重要的進展就是膦配合物或 NHC 配位金 (I) 配合物的開發,這導致了科學家們對金催化在合成上應用的興趣明顯地增加。金(I) 配合物通常以穩定的(但活性低的)氯化物,即 LAuCl 的形式製備和儲存,例如三苯基膦氯化亚金,通常通過使用 AgOTf、AgBF4、或 AgSbF6等銀鹽來活化,生成金 (I) 陽離子物種[8][9] 。儘管不飽和絡合物 LAu+ 理論上是由 LAuCl/AgX 的混合物所生成的,但陽離子性金化合物的確切性和銀鹽的作用仍然在某程度上受到爭議[10][11][12]。
與杜瓦-查特-邓肯森配位相符,帶正電荷的金(I)化合物能夠跟烯烴、炔烴的碳-碳雙鍵或三鍵生成π-配合物。除了金,數個跟氫正離子等瓣相似的金屬離子如Hg(II)和Pt(II)都能夠呈現相似的鍵合和活性。此等對於生成π-配合物有强趨勢的親電性的離子或配合物可被稱作π-酸[13]。
金(I)-烯烴和金-炔絡合物具有親電性,並且易受親核體進攻。在羟汞化反应中,有機汞化合物是按化學計量而生成的,而且,釋放產物是需要額外的步驟來進行的。在有機金化學中,金的解離使催化循環得以完成,讓另一分子的受體得以與金配位。金(I)絡合物很少會被氧化至更高氧化態,而且金(I)-烷基和-乙烯基不易發生β-氫消除反應[14]。
以下列舉一些金(I)催化劑的好處:
- 對空氣穩定
- 對少量外來的水分有耐受性
- 比起Hg(II)和Pt(II)等其他π-酸毒性較低
發展歷史
[编辑]於1976年,Thomas等人發現在氯金酸中,苯乙炔可轉化作苯乙酮,產率為37%[15]。在這個反應中,三價金作爲均相催化劑,類似於羟汞化反应中的汞。
在1991年,Utimoto將氯金酸鈉、炔烴與水反應[16]。Teles提出了這個反應的主要問題:三價金很容易還原成沒有催化性質的金屬金,並於1998年在此反應中使用配體支撐的一價金[17] 。這反應得到非常高的催化效率,而且會激起大量對用膦-金配合物來活化碳-碳雙或三鍵的研究[18]。
雖然三價金在催化反應的條件當中比較不穩定,三氯化金仍是一個有效的催化劑。例如,Hashmi報道過三氯化金可催化炔烴、呋喃之間的狄耳士–阿爾德反應來生成2,3-雙取代酚類化合物,這類的環加成反應一般不會發生[19]。
進一步對反應機理的研究表明這反應並非采用協同反應機理。第一步為炔烴的氫芳基化反應,然後發生一連串分子内重排,最後是6π電環化反應,並重新構成芳香環。
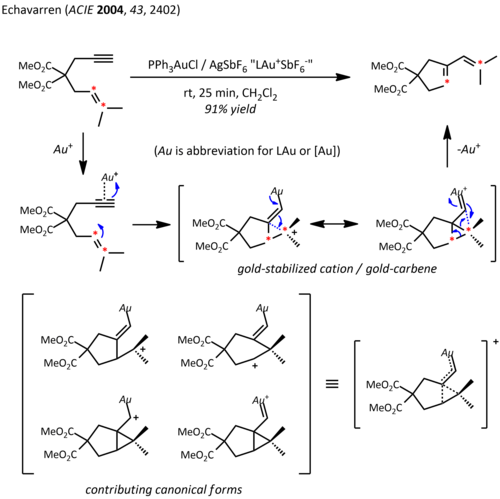
由於金核電荷較大(Z = 79),相對論效應在有機金化學中非常顯著。相對論效應使得5d軌道擴張,因此LAu 碎片可以通過向空 p 軌道提供電子去穩定鄰近的碳陽離子。因此,這些碳陽離子除了有碳陽離子的屬性與活性,更展現出卡賓的特徵,這允許它們參與環丙烷化反應、C-H鍵插入反應等[20] 。丙炔酯類化合物可以成爲金-乙烯基卡賓中間體的前體,這些中間體可以和烯烴發生協同的環丙烷化反應。(R)-DTBM-SEGPHOS等手性配體的使用使得反應的对映选择性很好[21]。


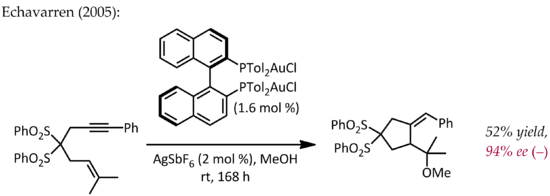
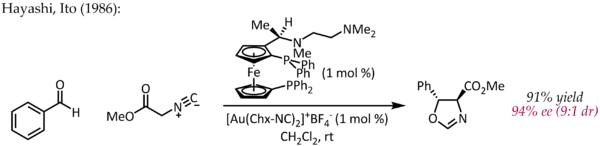
儘管 Echavarren 首先報導了通過典型的π-活化機理去製備用於不對稱金催化的手性雙膦二金(I) 配合物[22],但 Hayashi 和 Ito 早在 1986 年就描述了一個不尋常的金不對稱催化[23]。在這個反應中,苯甲醛和異氰乙酸甲酯在手性配體二茂鐵膦和雙(異氰化物)金(I)配合物存在下成環,生成帶手性的噁唑啉。噁唑啉可以水解,生成 1,2-氨基醇,因此該反應可以說是不對稱金催化羥醛縮合反應的第一個例子。
跟以上描述的金催化反應不同,這個反應並不涉及碳-碳雙鍵或三鍵的活化。簡單而言,一價金同時與兩個膦配體、異氰酸根配體配位[24] ,之後被羰基進攻。然而,進一步對於一價金鍵合的研究顯示這個對反應機理的簡單描述需要被修改。
異相金催化歷史比較悠久。使用金的好處為:金穩定而不容易氧化,并且金的形貌比較豐富(例如金簇)。金催化已被證明低溫中一氧化碳的氧化和乙炔氫氯化成氯乙烯等反應有效。在這類的反應中,活性位點的性質仍在爭論中[25]。然而,對金催化的討論不代表金是唯一可用的催化劑。實際上,其他金屬仍可達到催化效果,而且成本較低。近年的例子有鐵催化。
金催化反應
[编辑]金化合物能催化許多有機反應。一價金常用以催化碳-碳鍵的生成,而三價金用以催化碳-氧鍵或碳-氮鍵的生成,因爲三價金離子的路易斯酸性比較高。在過往十年中,多項研究表明金可以有效通過 Au(I)/Au(III) 循環催化碳-碳和碳-雜原子的交叉偶聯反應[26]。Hong C. Shen 將均相的成環反應總結為 4 大類:[27]
其他金催化的反應如:碳-氢键活化反應[31]、偶联反应[32]、羥醛縮合。
缺點
[编辑]對於金催化的加氢官能化反应而言,炔烴、累積二烯烴、烯丙基醇類化合物能夠在較溫和的條件發生反應[33]。然而,沒有活化的烯烴在大多數情況之下是很差的底物[34] ,主要因爲反應中間體烷基金(I)配合物中的金難以脫離[35]。分子間金催化反應的發展亦比分子内的慢[36]。
參考資料
[编辑]- ^ 1.0 1.1 Elschenbroich, C. and Salzer, A. (1992) Organometallics : A Concise Introduction. Wiley-VCH: Weinheim. ISBN 3-527-28165-7
- ^ 2.0 2.1 Parish, R. V. Organogold chemistry: II reactions. Gold Bulletin. 1997, 30 (2): 55–62. doi:10.1007/BF03214757
 .
.
- ^ 3.0 3.1 Parish, R. V. Organogold chemistry: III applications. Gold Bulletin. 1998, 31: 14–21. doi:10.1007/BF03215470
 .
.
- ^ Schmidbaur, Hubert; Schier, Annette. Aurophilic interactions as a subject of current research: an up-date. Chemical Society Reviews. 2011-12-05, 41 (1): 370–412. ISSN 1460-4744. PMID 21863191. doi:10.1039/C1CS15182G (英语).
- ^ Wang, X. B.; Wang, Y. L.; Yang, J.; Xing, X. P.; Li, J.; Wang, L. S. Evidence of Significant Covalent Bonding in Au(CN)2−. Journal of the American Chemical Society. 2009, 131 (45): 16368–70. PMID 19860420. doi:10.1021/ja908106e.
- ^ Gold catalysis for organic synthesis F. Dean Toste (Editor) Thematic Series (页面存档备份,存于互联网档案馆) in the Open Access Beilstein Journal of Organic Chemistry
- ^ Raubenheimer, H. G.; Schmidbaur, H. The Late Start and Amazing Upswing in Gold Chemistry. Journal of Chemical Education. 2014, 91 (12): 2024–2036. Bibcode:2014JChEd..91.2024R. doi:10.1021/ed400782p.
- ^ Ranieri, Beatrice; Escofet, Imma; Echavarren, Antonio M. Anatomy of gold catalysts: facts and myths. Org. Biomol. Chem. 2015-06-24, 13 (26): 7103–7118. ISSN 1477-0539. PMC 4479959
 . PMID 26055272. doi:10.1039/c5ob00736d (英语).
. PMID 26055272. doi:10.1039/c5ob00736d (英语).
- ^ Wang, Yi-Ming; Lackner, Aaron D.; Toste, F. Dean. Development of Catalysts and Ligands for Enantioselective Gold Catalysis. Accounts of Chemical Research. 2013-11-14, 47 (3): 889–901. PMC 3960333
 . PMID 24228794. doi:10.1021/ar400188g (英语).
. PMID 24228794. doi:10.1021/ar400188g (英语).
- ^ Zhdanko, Alexander; Maier, Martin E. Explanation of "Silver Effects" in Gold(I)-Catalyzed Hydroalkoxylation of Alkynes. ACS Catalysis. 2015-09-09, 5 (10): 5994–6004. doi:10.1021/acscatal.5b01493 (英语).
- ^ Homs, Anna; Escofet, Imma; Echavarren, Antonio M. On the Silver Effect and the Formation of Chloride-Bridged Digold Complexes. Organic Letters. 2013, 15 (22): 5782–5785. PMC 3833279
 . PMID 24195441. doi:10.1021/ol402825v.
. PMID 24195441. doi:10.1021/ol402825v.
- ^ Wang, Dawei; Cai, Rong; Sharma, Sripadh; Jirak, James; Thummanapelli, Sravan K.; Akhmedov, Novruz G.; Zhang, Hui; Liu, Xingbo; Petersen, Jeffrey L. "Silver Effect" in Gold(I) Catalysis: An Overlooked Important Factor. Journal of the American Chemical Society. 2012-05-18, 134 (21): 9012–9019. PMID 22563621. doi:10.1021/ja303862z (英语).
- ^ Fürstner, A.; Davies, P. W. Catalytic Carbophilic Activation: Catalysis by Platinum and Gold π Acids. Angewandte Chemie International Edition. 2007, 46 (19): 3410–3449. PMID 17427893. doi:10.1002/anie.200604335.
- ^ Shen, H. C. Recent advances in syntheses of heterocycles and carbocycles via homogeneous gold catalysis. Part 1: Heteroatom addition and hydroarylation reactions of alkynes, allenes, and alkenes. Tetrahedron. 2008, 64 (18): 3885–3903. doi:10.1016/j.tet.2008.01.081.
- ^ Norman, R. O. C.; Parr, W. J. E.; Thomas, C. B. The reactions of alkynes, cyclopropanes, and benzene derivatives with gold(III). Journal of the Chemical Society, Perkin Transactions 1. 1976, (18): 1983. doi:10.1039/P19760001983.
- ^ Fukuda, Y.; Utimoto, K. Effective transformation of unactivated alkynes into ketones or acetals with a gold(III) catalyst. The Journal of Organic Chemistry. 1991, 56 (11): 3729–3731. doi:10.1021/jo00011a058.
- ^ Teles, J. H.; Brode, S.; Chabanas, M. Cationic Gold(I) Complexes: Highly Efficient Catalysts for the Addition of Alcohols to Alkynes. Angewandte Chemie International Edition. 1998, 37 (10): 1415–1418. PMID 29710887. doi:10.1002/(SICI)1521-3773(19980605)37:10<1415::AID-ANIE1415>3.0.CO;2-N
 .
.
- ^ Nugent, W. A. "Black Swan Events" in Organic Synthesis. Angewandte Chemie International Edition. 2012, 51 (36): 8936–49. PMID 22893229. doi:10.1002/anie.201202348.
- ^ Hashmi, A. S. K.; Frost, T. M.; Bats, J. W. Highly Selective Gold-Catalyzed Arene Synthesis. Journal of the American Chemical Society. 2000, 122 (46): 11553–11554. doi:10.1021/ja005570d.
- ^ Gorin, David J.; Toste, F. Dean. Relativistic effects in homogeneous gold catalysis. Nature. 2007, 446 (7134): 395–403 [2023-09-09]. Bibcode:2007Natur.446..395G. PMID 17377576. S2CID 4429912. doi:10.1038/nature05592. (原始内容存档于2023-12-09).
- ^ Johansson, Magnus J.; Gorin, David J.; Staben, Steven T.; Toste, F. Dean. Gold(I)-Catalyzed Stereoselective Olefin Cyclopropanation. Journal of the American Chemical Society. 2005-11-30, 127 (51): 18002–18003. PMID 16366541. doi:10.1021/ja0552500 (英语).
- ^ Muñoz, M. Paz; Adrio, Javier; Carretero, Juan Carlos; Echavarren, Antonio M. Ligand Effects in Gold- and Platinum-Catalyzed Cyclization of Enynes: Chiral Gold Complexes for Enantioselective Alkoxycyclization. Organometallics. 2005-02-12, 24 (6): 1293–1300. doi:10.1021/om0491645 (英语).
- ^ Ito, Y.; Sawamura, M.; Hayashi, T. Catalytic asymmetric aldol reaction: Reaction of aldehydes with isocyanoacetate catalyzed by a chiral ferrocenylphosphine-gold(I) complex. Journal of the American Chemical Society. 1986, 108 (20): 6405–6406. doi:10.1021/ja00280a056.
- ^ Togni, A.; Pastor, S. D. Chiral cooperativity: The nature of the diastereoselective and enantioselective step in the gold(I)-catalyzed aldol reaction utilizing chiral ferrocenylamine ligands. The Journal of Organic Chemistry. 1990, 55 (5): 1649–1664. doi:10.1021/jo00292a046.
- ^ Hutchings, G. J.; Brust, M.; Schmidbaur, H. Gold—an introductory perspective. Chemical Society Reviews. 2008, 37 (9): 1759–65. PMID 18762825. doi:10.1039/b810747p.
- ^ Nijamudheen, A.; Datta, Ayan. Gold‐Catalyzed Cross‐Coupling Reactions: An Overview of Design Strategies, Mechanistic Studies, and Applications. Chemistry: A European Journal. 2020, 26 (7): 1442–1487. PMID 31657487. S2CID 204947412. doi:10.1002/chem.201903377.
- ^ Shen, H. C. Recent advances in syntheses of carbocycles and heterocycles via homogeneous gold catalysis. Part 2: Cyclizations and cycloadditions. Tetrahedron. 2008, 64 (34): 7847–7870. doi:10.1016/j.tet.2008.05.082.
- ^ Reetz, M. T.; Sommer, K. Gold-Catalyzed Hydroarylation of Alkynes. European Journal of Organic Chemistry. 2003, 2003 (18): 3485–3496. doi:10.1002/ejoc.200300260.
- ^ Nieto-Oberhuber, C.; Muñoz, M. P.; Buñuel, E.; Nevado, C.; Cárdenas, D. J.; Echavarren, A. M. Cationic Gold(I) Complexes: Highly Alkynophilic Catalysts for theexo- andendo-Cyclization of Enynes. Angewandte Chemie International Edition. 2004, 43 (18): 2402–2406. PMID 15114573. doi:10.1002/anie.200353207.
- ^ Gasparrini, F.; Giovannoli, M.; Misiti, D.; Natile, G.; Palmieri, G.; Maresca, L. Gold(III)-catalyzed one-pot synthesis of isoxazoles from terminal alkynes and nitric acid. Journal of the American Chemical Society. 1993, 115 (10): 4401–4402. doi:10.1021/ja00063a084.
- ^ Hoffmann-Röder, A.; Krause, N. The golden gate to catalysis. Organic & Biomolecular Chemistry. 2005, 3 (3): 387–91. PMID 15678171. doi:10.1039/b416516k.
- ^ Wegner, H. A.; Auzias, M. Gold for C-C coupling reactions: a Swiss-Army-knife catalyst?. Angewandte Chemie International Edition. 2011, 50 (36): 8236–47. PMID 21818831. doi:10.1002/anie.201101603.
- ^ Bandini, Marco. Allylic Alcohols: Sustainable Sources for Catalytic Enantioselective Alkylation Reactions. Angewandte Chemie International Edition. 2011-02-01, 50 (5): 994–995. ISSN 1521-3773. PMID 21268189. doi:10.1002/anie.201006522. hdl:11585/96637
 (英语).
(英语).
- ^ Zhang, Zhibin; Lee, Seong Du; Widenhoefer, Ross A. Intermolecular Hydroamination of Ethylene and 1-Alkenes with Cyclic Ureas Catalyzed by Achiral and Chiral Gold(I) Complexes. Journal of the American Chemical Society. 2009-04-22, 131 (15): 5372–5373. ISSN 0002-7863. PMC 2891684
 . PMID 19326908. doi:10.1021/ja9001162.
. PMID 19326908. doi:10.1021/ja9001162.
- ^ LaLonde, Rebecca L.; Brenzovich, William E. Jr.; Benitez, Diego; Tkatchouk, Ekaterina; Kelley, Kotaro; III, William A. Goddard; Toste, F. Dean. Alkylgold complexes by the intramolecular aminoauration of unactivated alkenes. Chemical Science. 2010, 1 (2): 226. PMC 3866133
 . PMID 24358445. doi:10.1039/C0SC00255K (英语).
. PMID 24358445. doi:10.1039/C0SC00255K (英语).
- ^ Muratore, Michael E.; Homs, Anna; Obradors, Carla; Echavarren, Antonio M. Meeting the Challenge of Intermolecular Gold(I)-Catalyzed Cycloadditions of Alkynes and Allenes. Chemistry: An Asian Journal. 2014-11-01, 9 (11): 3066–3082. ISSN 1861-471X. PMC 4676923
 . PMID 25048645. doi:10.1002/asia.201402395 (英语).
. PMID 25048645. doi:10.1002/asia.201402395 (英语).