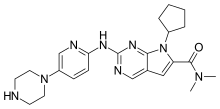
瑞博西利
外观
 | |
| 臨床資料 | |
|---|---|
| 商品名 | Kisqali |
| 其他名稱 | LEE 011 |
| AHFS/Drugs.com | kisqali |
| MedlinePlus | a617008 |
| 给药途径 | By mouth (tablets) |
| ATC碼 | |
| 法律規範狀態 | |
| 法律規範 | |
| 藥物動力學數據 | |
| 生物利用度 | Unknown |
| 血漿蛋白結合率 | ~70% |
| 药物代谢 | Liver (CYP3A4) |
| 生物半衰期 | 32.0 (29.7–54.7) hrs |
| 排泄途徑 | 69% feces, 23% urine |
| 识别信息 | |
| |
| CAS号 | 1211441-98-3 |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEMBL | |
| CompTox Dashboard (EPA) | |
| ECHA InfoCard | 100.234.566 |
| 化学信息 | |
| 化学式 | C23H30N8O |
| 摩尔质量 | 434.55 g·mol−1 |
| 3D模型(JSmol) | |
| |
| |
瑞博西利(英語:Ribociclib)商品名擊癌利(KISQALI)是一種CDK4/6抑制劑類型的乳腺癌藥物[1][2],由Astex和诺华制药研发[3]。可使用的對象為:賀爾蒙接受體陽性、HER2陰性患者,以及停經後晚期乳腺癌患者。
参考文献
[编辑]- ^ FDA专业药物信息 on Kisqali. Accessed 2017-09-08.
- ^ Samson, Kurt. LEE011 CDK Inhibitor Showing Early Promise in Drug-Resistant Cancers. Oncology Times. 2014, 36 (3): 39–40. doi:10.1097/01.COT.0000444043.33304.c1.
- ^ Novartis LEE011 (ribociclib) granted FDA Priority Review for first-line treatment of HR+/HER2- advanced breast cancer. Novartis. 2016-11-01 [2018-07-20]. (原始内容存档于2018-09-25).
