碳
碳(英語:Carbon;拉丁語:Carbonium,意為「煤炭」),是一種化學元素,化學符號为C,原子序數为6,原子量為12.011 u,位於元素週期表中的IV A族,屬於非金屬。每個碳原子有四顆能夠進行鍵合的電子,因此其化合價通常為4。自然產生的碳由三種同位素組成:12C和13C為穩定同位素,而14C則具放射性,其半衰期約為5730年。[12]碳是少數幾個自遠古就被發現的元素之一(見化學元素發現年表)。[13]
碳的同素異形體有數種,最常見的包括:石墨、鑽石及無定形碳。[14]這些同素異形體之間的物理性質,包括外表、硬度、電導率等等,都具有極大的差異。在正常條件下,鑽石、碳納米管和石墨烯的熱導率是已知材質中最高的。
所有碳的同素異形體在一般條件下都呈固态,其中石墨的熱力學穩定性最高。它們不易受化學侵蝕,甚至連氧都要在高溫下才可與其反應。碳在無機化合物中最常見的氧化態為+4,並在一氧化碳及過渡金屬羰基配合物中呈+2態。無機碳主要來自石灰石、白雲石和二氧化碳,但也大量出現在煤、泥炭、石油和甲烷水合物等有機礦藏中。碳是所有元素中化合物种类最多的,目前有近一千萬種已記錄的純有機化合物,但這只是理論上可以存在的化合物中的冰山一角。[15]
碳的豐度在地球地殼中排列第15(见地球的地殼元素豐度列表),並在全宇宙中排列第4(见化學元素豐度),名列氫、氦和氧之下。由於碳元素極為充沛,再加上它在地球環境下所能產生的聚合物種類極為繁多,因此碳是地球上所有生物的化學根本。[16]
特性
[编辑]
碳的各種同素異形體的物理特性差異極大,例如鑽石是最堅硬的天然物質,而石墨則是最柔軟的物質之一。碳可以和眾多較小原子(包括碳原子)產生多個共價鍵,因此碳化合物的總數是各個元素中最高的,已发现的有近一千萬種,佔所有已知化合物的絕大多數。[15]碳的昇華點是所有元素中最高的。在標準大氣壓下,碳沒有熔點,因為它的三相點位於MPa、K(約4,330°C),[5][6]而是會在3,900K左右昇華。[17][18]因此所有碳同素異形體的固體溫度上限比熔點最高的金屬還要高,如鎢和釕。雖然碳能夠進行氧化反應,但它的耐氧化性比鐵和銅等元素都強。
碳化合物是地球上所有生物的化學基礎。碳氮氧循環反應是太陽以及其他恒星內部部分能量的來源。雖然碳擁有上千萬種化合物,但碳在一般條件下的化學性質並不活躍。在標準溫度和壓力下,碳能夠抵抗幾乎所有的氧化劑,並只會與最強的氧化劑反應。無論是硫酸、盐酸、氯還是任何鹼,都無法侵蝕碳。在高溫条件下,碳會和氧反應形成碳氧化物(CO、),也會把金屬氧化物還原為純金屬,例如将氧化鐵还原为游离态铁。這一放熱反應應用於鋼鐵工業中,用以控制鋼鐵的碳含量:
碳能和某些金屬在高溫下形成碳化物,如鋼鐵中的Fe
3C及用作製造堅硬鑽頭磨料的碳化鎢等。
截至2009年,石墨烯是所有已知物質中最堅固的。[19]然而從石墨中分離出石墨烯的過程需要更進一步的完善才能在工業中應用。[20]
碳的各種同素異形體有著兩極化的異常特性:
| 人造鑽石納米晶體是最堅硬的物質。[21] | 石墨是最柔軟的物質之一。 |
| 鑽石是極佳的磨料。 | 石墨是極佳的潤滑劑,甚至具超潤滑性。[22] |
| 鑽石是高絕緣體。[23] | 石墨是高導電體[24] |
| 鑽石是導熱率最高的物質之一。 | 石墨可用作熱絕緣體。 |
| 鑽石透明。 | 石墨為不透明黑色。 |
| 鑽石晶體結構屬於立方晶系。 | 石墨晶體結構屬於六方晶系。[25] |
| 無定形碳具各向同性。 | 碳納米管是各向異性最強的物質之一。 |
同素異形體
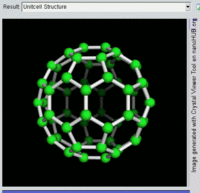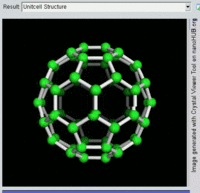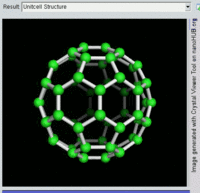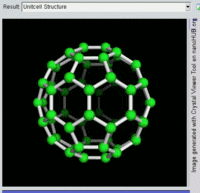
[编辑]單原子碳的存活時間極短,因此碳一般以多原子形態穩定存在,這些碳原子的不同排布方式稱為同素異形體。最常見的三種碳同素異形體為無定形碳、石墨及鑽石。富勒烯曾經是新發現的奇異物質,但今天已大量生產,受到了科學家的深入研究。富勒烯共包括巴基球、[26][27]碳納米管、[28]碳納米芽[29]及碳納米纖維等。[30][31]其他同素異形體還有:藍絲黛爾石、[32]玻璃碳、[33]碳納米泡沫[34]及直鏈乙炔碳等等。[35]

碳的無定形體是碳原子以非晶體形式不規則排列時形成的玻璃態物質,也就是不具備宏觀晶體結構的石墨。無定形碳呈粉末狀,是煤炭、煤煙(炭黑)及活性炭的主要成份。在正常壓力下,碳以石墨的形式存在,其中每個碳原子都和另外三個碳原子鍵合,形成平面六邊形環平鋪結構。[36]這一種網狀平面結構能夠層疊起來,每層間有弱范德華力。因此石墨性質柔軟,也可作潤滑劑(因為層與層間能輕易平行滑動)。由於石墨中每個碳原子都有一顆外層離域電子,共同形成遍佈整個平面的π-雲,所以電能順著石墨的每個共價鍵合平面上傳導。因此碳的整體電導率低於大部分金屬。由於含有離域電子,因此在標準條件下石墨比鑽石更加穩定。

在極高壓力下,碳會形成原子排布更緊密的鑽石,其密度幾乎為石墨的兩倍。鑽石中的每個碳原子以四面體狀與另外四個碳原子鍵合,形成一個三維密鋪網狀結構。鑽石晶體屬立方晶系與矽和鍺相同。由於碳-碳共價鍵非常強,因此鑽石是最抗刮損的天然材質。雖然民間有「鑽石是永恆的」一說,但實際上鑽石在標準環境下並不具備熱力學穩定性,而且會轉變為石墨。[14]然而由於轉變需要較高的活化能,所以該過程極為緩慢,肉眼無法觀察。碳在某些情況下會結晶成藍絲黛爾石。這一形態為六方晶體,所有碳原子間都以共價鍵鍵合。因此藍絲黛爾石與鑽石特性相近。[32]
富勒烯的結構與石墨相似,但除了六角碳原子環以外,它還含有五角環和七角環。這些環鑲嵌成平面,卷縮成球體、橢球體和圓柱體等形狀。各種富勒烯(包括巴基球、碳納米管和碳納米芽)的特性仍尚待研究,屬於納米材料科學的範疇。「富勒烯」(Fullerene)和「巴基球」(Buckyball)是以推廣網格球頂作為建築結構的建築師巴克敏斯特·富勒(Buckminster Fuller)命名的,而網格球頂與富勒烯的幾何結構相似。巴基球是較大的純碳單質分子,每個碳原子與三個碳原子鍵合,形成橢球體(最簡單的一種為足球形的,亦即巴克敏斯特富勒烯)。[26]碳納米管則是碳原子六角形密鋪平面所卷縮而成的管狀(圓柱體)分子。[27][28]2007年,科學家首次宣佈發現碳納米芽,一種巴基球和碳納米管的混合體(巴基球鍵合在碳納米管壁上)。碳納米芽同時具有巴基球和碳納米管的屬性。[29]
其他同素異形體還有碳納米泡沫,發現於1997年,具鐵磁性。碳納米泡沫由眾多碳原子低密度聚集而成,每個原子與三個碳原子鍵合,形成由六角或七角環串聯而成的鬆散三維網格。它是已知最輕的固體之一,密度約為2kg/m3。[37]同樣,玻璃碳也含有大量的內部氣孔。[33]但與普通石墨不同,其每一層並不平行層疊,而是以相對隨機的方式排布。直鏈乙炔碳[35]的化學結構為[35]。這一分子呈直鏈型,具有sp混成軌域,是一種在三鍵和單鍵之間交替的聚合物。其楊氏模量是世\,因此在納米科技中有相當的研究空間。[38]
存量
[编辑]


碳在全宇宙各元素中總質量排列第四,位於氫、氦和氧之後。碳大量存在於彗星、大部分行星大氣層、太陽以及其他恒星中。一些隕石含有太陽系還處於原行星盤時所遺留下來的微鑽石。隕石撞擊時的巨大溫度和壓力也會在撞擊坑處形成微鑽石。[39]
碳與氧結合成二氧化碳,大量存在於地球大氣中(當中約有8100億噸碳)並溶解在所有水體中(約有36萬億噸碳)。整個生物圈共含有約1.9萬億噸碳。碳氫化合物(如煤、石油和天然氣)同樣含有碳:煤礦儲備共有約9000億噸碳,石油儲備有約1500億噸碳,而天然氣則有約1050億噸碳,但仍不包括頁岩氣等非常規天然氣源(含有5400億噸碳)。[40]碳也封存在地球兩極和海底的甲烷水合物中,碳含量估計共有5千億至2萬5千億噸,[41]另有研究估計含量為3萬億噸。[42]過去的碳氫化合物含量比今天要多。從1751年至2008年有大約3470億噸碳在化石燃料燃燒過程中以二氧化碳的形式釋放到大氣層中。[43]
碳酸鹽岩石(石灰石、白雲石、大理石等等)中含有大量的碳。最大的碳礦石來源是煤,佔化石燃料的80%。[44]
若以個別同素異形體計算,則石墨主要位於美國(以紐約州及德克薩斯州為主)、俄羅斯、墨西哥、格陵蘭和印度。天然鑽石主要出現在古火山的「頸部管道」部分的金伯利岩內。大部分鑽石礦藏都位於非洲,其中以南非、納米比亞、博茨瓦納、剛果共和國及塞拉里昂居多。其他礦藏地點包括美國阿肯色州、加拿大、俄羅斯北極圈內、巴西以及西澳洲。好望角對出的洋底也有進行鑽石的開採。雖然自然界中存在著不少鑽石,但是在美國有30%的工業用鑽石都是人工合成的。
宇宙射線會在海拔9至15公里的對流層和平流層處產生碳-14。[45]這一反應中,熱中子撞擊氮-14原子核,形成碳-14原子核及一顆質子。
同位素
[编辑]所有碳同位素的原子都有6顆質子,但中子數各異(從2到16顆不等)。碳有兩個自然存在的穩定同位素:[12]碳-12()佔地球上碳的98.93%,而碳-13()則佔剩餘的1.07%。[12]生物體中同位素的比率更高,因為生物化學反應會選擇性地消除。[46]1961年,國際純粹與應用化學聯合會(IUPAC)決定以碳-12同位素作為原子量單位的定義標準。[47]核磁共振所探測的就是。
碳-14()是自然產生的放射性同位素,在地球上的豐度為一萬億分之一(0.0000000001%),主要存在於大氣層和地表礦藏中,如泥炭及其他有機物質等。[48]碳-14以0.158 MeV能量進行β−衰變。由於半衰期只有5730年,所以該同位素在古老岩石中幾乎絕跡,但會在大氣高層(低平流層及高對流層)中經宇宙射線和氮間的反應而不斷產生。[49]14C在大氣層及生物體中的豐度幾乎守恆,但在生物體死亡後有規律地衰減,這就是放射性碳定年法的原理。該定年法可測量年齡在4萬年以下的含碳物質。[50][51]
碳有15種已知同位素,其中半衰期最短的是,它會進行質子發射,半衰期為3.5×10-21秒。[52]同位素有核暈效應,即其半徑比密度均勻的正常球體原子核高得多。[53]
星體內部核合成
[编辑]碳原子核的合成需要在巨星或超巨星內部,通過3顆α粒子(氦原子核)幾乎同時互相撞擊而形成,稱為3氦過程。進一步與氫或氦融合後分別產生的鋰-5和鈹-8都很不穩定,因此會迅速衰變回較小的原子核。[54]這種情況下的溫度達到1億開爾文,所需的氦濃度極高。大爆炸後的宇宙迅速膨脹、冷卻,因此大爆炸沒有產生大量的碳元素。赫羅圖中的水平分支恒星則具備3氦過程的所需條件,可以大量生成碳。[55]超新星爆炸再將這些恒星內部的碳散佈到太空中,這些含碳的塵埃聚合形成第二代、第三代恒星及其行星。太陽系屬於第三代恒星系統,因此地球生物所賴以為生的碳元素,最初也是在巨大恒星的內部合成的。[56]另外,通過碳氮氧循環過程,碳作為聚變反應的催化劑,為恒星提供了絕大部分的能量。
亞毫米波天文學能夠探測到含不同碳同位素的一氧化碳間的循環轉換(、及),這可用於研究分子雲中剛剛形成的恒星。[57]
碳循環
[编辑]
在地球上並不容易發生元素間的轉變,因此地球上的碳基本上是守恆的。任何使用到碳的物理及化學過程都必須從一處取得碳,並在過程後轉移到另一處。環境中碳所遵循的路徑稱為碳循環。例如,植物從周圍環境中吸取二氧化碳,用以增加自身質量。動物可能會進食一部分植物體,並再以二氧化碳把碳還原到環境中。整個碳循環實際上複雜得多,比如一些二氧化碳會溶解在海洋中,動植物死亡後也會成為石油或煤,再經焚燒把碳還原到大氣中。[58][59]
化合物
[编辑]有機化合物
[编辑]

碳能夠形成串連的鍵,形成很長的分子鏈,這種特性叫做成鏈。碳-碳鍵強而穩定。因此,碳可以形成幾乎無限種不同的化合物。其實,碳化合物的數量比其他所有元素的化合物加起來還要多(除氫以外,因為大部分碳化合物都含有氫)。
最簡單的有機分子是碳氫化合物。這些化合物以一條碳鏈為主幹,並有氫原子鍵合在碳鏈上。鏈長、支鏈及官能團等都會影響有機化合物的物理及化學特性。
所有生物體中都含有碳,並以碳作為有機化學的基礎。碳氫化合物在工業上可用作製冷劑、潤滑劑、溶劑、塑料的製造原料、化石燃料等等。
碳與氧和氫結合後,會形成眾多必不可少的生物化合物,包括糖、木酯素、甲殼素、醇、脂、酯、類胡蘿蔔素、萜烯等等。碳與氮結合會形成生物鹼,再加上硫後會形成抗生素、氨基酸及橡膠等等。最後加入磷,會形成生命所需的化學編碼分子DNA及RNA,以及生物細胞用以傳遞能量的三磷酸腺苷(ATP)。
無機化合物
[编辑]礦石中的含碳物質以及不含氫或氟的碳化合物一般不歸於有機化合物中,但這種定義並不是絕對的。這些無機化合物包括最簡單的各種氧化碳,其中最重要的就是二氧化碳()。二氧化碳曾是古大氣層的主要成份,但今天則只佔地球大氣層中的極小一部分。[60]當二氧化碳溶於水後,會形成碳酸()。但由於有多個氧原子以單鍵連結到一顆碳原子上,所以它並不穩定。[61]然而通過這一中繼狀態,因共振而穩定的碳酸鹽離子得以形成。一些重要的岩石都含有碳酸鹽,如石灰岩、白堊岩和大理石等。
另一常見的碳氧化物是一氧化碳(),一種在不完全燃燒後產生的無色、無味的氣體。一氧化碳分子中有一個三鍵,而且極性非常強,所以會不可逆轉地與血紅蛋白分子結合,使得親和力較低的氧無法經血紅蛋白傳輸。[62][63]氰化物()的結構相似,但其特性更類似於鹵素離子(擬鹵素)。例如,氰分子()與雙原子鹵素相似。其他較罕見的氧化物包括二氧化三碳()、[64]不穩定的一氧化二碳()、[65][66]三氧化碳()[67][68]環戊五酮()、[69]環己六酮()[69]和苯六甲酸酐()。
當碳遇到如鎢等活性較強的金屬時,會形成碳化物()或乙炔化物(),大大提高這些合金的熔點。碳的電負性為2.5,[70]所以會主要形成共價鍵。碳有幾種共價鍵晶格化合物,如結構與鑽石相近的碳化矽()。
金屬有機化合物
[编辑]金屬有機化合物是任何具有碳-金屬鍵的化合物。金屬有機化合物類別繁多,主要分為烷基金屬化合物(如四乙基鉛)、η2烯烴化合物(如蔡斯鹽)和η3烯丙基化合物(如氯化烯丙基鈀二聚物);含環戊二烯配位體的茂金屬(如二茂鐵);以及過渡金屬卡賓配合物。金屬羰基配合物有很多種,包括四羰基鎳等。
歷史
[编辑]
中文的「碳」字為形聲字,以石部表示固體非金屬,並以「炭」旁表示碳元素源自木炭或煤炭等物質。韓文及日文中碳的漢字寫法均為「炭素」。[71]在英文中,carbon來自拉丁文的carbo,即煤炭和木炭;[72]法文中的charbon同樣也是木炭的意思。德文、荷蘭文和丹麥文中碳分別寫作Kohlenstoff、koolstof和kulstof,都是「炭物質」的意思。
最早的人類文明就已在煤煙和木炭中發現了碳。中國人早在公元前2500年就發現了鑽石。人們在古羅馬時代就開始通過在無氧環境下加熱木材製造木炭。[73][74]

1722年,勒内·列奥米尔發現鐵在轉變為鋼的過程中會吸收一種物質,今天人們知道這就是碳。[75]1772年,安東萬·拉瓦節證明鑽石是完全由碳組成的。他燃燒了木炭和鑽石,發現兩者都沒有產生水,而且形成的二氧化碳質量相同。[76]人們曾以為石墨是鉛的一種形態,但卡爾·威廉·舍勒在1779年證明了它和木炭相同,但混有小量鐵,並會經硝酸氧化之後釋放二氧化碳。[77]1786年,法國科學家克勞德·貝托萊、加斯帕·蒙日和沙爾·奧古斯丁·范德蒙以拉瓦節對鑽石所用的方法證明,石墨同樣主要由碳組成。[78]石墨在燃燒後同樣留下了鐵,因此他們以為鐵在石墨結構中是必要的。拉瓦節在他1789年的教科書中將碳列為化學元素。[3]
1985年,科學家發現了一種新的碳單質富勒烯,[79]其中包括巴基球、碳納米管等等。[26]發現者羅伯特·柯爾、哈羅德·克羅托和理查德·斯莫利因此獲得了1996年的諾貝爾化學獎。[80]其他奇特的碳同素異形體也被陸續發現了,例如玻璃碳。[33]
生產
[编辑]石墨
[编辑]大量天然石墨礦藏分佈在世界各地,其中主要出產國為中國、印度、巴西和朝鮮。石墨礦石都是變質岩,與石英、片岩中的雲母和長石、片麻岩及變質砂岩和石灰岩一同出現,呈透鏡狀或葉脈狀,厚度可達1米多。位於英國坎伯蘭博羅戴爾(Borrowdale)的石墨礦藏巨大且純度高,直到19世紀,人們都直接鋸下石墨塊,削成條狀後包在木條中,作鉛筆出售。今天,要從較小的石墨礦中提取石墨,需要把礦石壓碎後,用水浮出較輕的石墨。[81]
天然石墨以三種形式出現:無定形態、薄片狀或結晶薄片狀以及葉脈狀或塊狀。無定形石墨的質量最低,但也最常見,一般被用於生產價值最低的產品。在工業中「無定形」指的是晶體細小,而非科學中所指的完全缺乏晶體結構。無定形石墨大量出現在位於中國、歐洲、墨西哥以及美國的大型礦藏中。薄片狀石墨的價值更高,也較少見,通常出現在變質岩中。質量較高的薄片石墨價格可以是無定形石墨的4倍,可製成一膨脹性石墨,用作阻燃劑等。薄片石墨出產於巴西、加拿大、中國、德國和馬達加斯加。葉脈狀或塊狀石墨最為罕見,是天然石墨中質量與價格最高的一種。這種石墨整塊出現在岩石與岩石之間,目前只有斯里蘭卡出產。[81]
根據美國地質調查局的數據,2010年全球石墨產量為1100萬噸,其中中國佔了80萬噸,印度13萬噸,巴西7.6萬噸,朝鮮3萬噸,加拿大2.5萬噸。美國沒有開採自然石墨,但2009年共生產了11.8萬噸合成石墨,估計總值9.98億美元。[81]
鑽石
[编辑]全球的鑽石生產由少數大型企業控制,而鑽石礦藏也只分佈在地球的少數地區。
鑽石礦石中只有極小部分是鑽石。在最初壓碎礦石時須避免損傷大塊鑽石,壓碎後再以密度分開各種粒子。今天,人們利用X射線熒光光譜儀能夠預先找到鑽石含量較高的部分,接著的分類過程則由人工進行。在X光科技普及之前,人們用塗上油脂的運輸帶提取鑽石。鑽石比礦石中其他的礦物更容易粘在油脂上。[82]
歷史上只有南印度出產鑽石。[83]自公元前9世紀左右至[84]公元18世紀中葉,印度都是世界唯一的鑽石產國。18世紀末,印度的礦藏已經衰減了許多,因此巴西1725年發現鑽石後,成為了印度以外的首個鑽石產地。[85]
1870年代人們發現了南非的鑽石礦場,才開始了對主要礦藏(金伯利岩及鉀鎂煌斑岩)的開採。產量不斷提高,截至2007年一共已有45億卡拉鑽石從當地開採出來。[86]鑽石在美國主要分佈在阿肯色州、科羅拉多州和蒙大拿州。[87][88]
今天經濟效益最高的鑽石產國有俄羅斯、博茨瓦納、澳洲及剛果共和國。[89]俄羅斯的鑽石產量為全球的五分之一。澳洲擁有鑽石含量最高的礦藏,其年產量在1990年代達到4200萬噸的頂峰。[87]其他的商業鑽石礦場位於加拿大加拿大、俄羅斯西伯利亞(大部分在雅庫特地區)、巴西以及澳洲北部和西部。
根据贝恩公司的报告,全球2018年钻石产量为1.47亿克拉,预计2019年产量为1.42亿克拉。[90]
應用
[编辑]





所有生物都依賴碳。如果沒有碳,我們所知的生物形態都不可能存在(見假定性生物化學)。除了作食物和木材以外,碳的最大用途是在化石燃料上(以碳氫化合物的形式),如天然氣和石油等。石油化學工業利用煉油廠把原油蒸餾成汽油和柴油。纖維素是一種植物製造的碳聚合物,出現在棉花和麻中。植物中的纖維素主要有支撐結構的作用。動物來源的碳聚合物有羊毛、羊絨和絲綢。塑料是人工合成的碳聚合物,一般在分子鏈中含有固定間隔的氧和氮原子。塑料的製造原料都可以從石油加工而成。
碳及其化合物的應用非常廣泛。碳可以和鐵形成合金,亦即鋼。石墨與粘土混合後可製成鉛筆芯,用於書寫和繪畫。石墨還能用作潤滑劑、顏料、玻璃生產過程中的鑄模材料、亁電池中或電鍍和電鑄過程中的電極、電動機中的碳刷以及核反應爐中的中子減速劑等等。
木炭可用於繪畫、燒烤、煉鐵等等。木材、煤炭和石油都可用作燃料,用以發電或保暖。高質量鑽石被用作首飾,而工業用鑽石則可在金屬或石頭上進行鑽孔、切割和磨光。化石燃料中的碳氫化合物能加工成塑料。聚酯纖維裂解後形成的碳纖維可以為塑料加固,產生輕盈的複合材料。碳纖維的製造原料為經拉伸過的聚丙烯腈(PAN)以及其他有機物質,其最終的晶體結構和力學屬性取決於初始原料和製作工序。由PAN做成的碳纖維結構與細長的石墨絲相似,而經過熱處理後,結構就會變成連續的一張薄片。這種纖維的拉伸比強度比鋼還要高。[91]
炭黑的應用包括:黑色顔料、印刷墨水、藝術油墨和水彩、碳式複寫紙、汽車油漆、墨和激光打印機碳粉。炭黑還可以用作橡膠和塑料的填充劑。活性炭可吸附、過濾物質,其應用範圍包括防毒面具、水淨化、廚房吸油煙機等,也可從消化系統中吸收毒物或氣體作醫學治療。碳在高溫下可以進行還原反應,如焦炭可將鐵礦石轉化為鐵金屬。鋼與碳粉末一起加熱後,可以達到表面硬化的作用。碳化矽、碳化鎢、碳化硼和碳化鈦都是超硬材料,在切割和碾磨時被用作磨料。幾乎所有衣料都由碳化合物組成,如人造紡織品和皮革等。不同形式的碳是有希望的催化剂或催化剂载体[92][93]和电极材料[94][95][96]。
鑽石
[编辑]鑽石工業可基本分為寶石級和工業級鑽石的生產和加工,兩種市場的運作方式截然不同。
寶石級鑽石交易市場巨大。但與金、鉑等貴金屬不同,鑽石寶石的交易並不像日用品:其利潤幅度很高,二手市場也不大。
工業用鑽石市場主要注重鑽石的硬度和熱導率,而幾乎忽略鑽石的清澈度和顔色。因此開採出來的鑽石中,有80%(即1億卡拉、20噸)無法用作寶石,需要轉到工業用途上。[97]1950年人工鑽石被發明之後,馬上就有了工業用途,年產量共有30億卡拉(600噸)。[98]鑽石在工業中主要被用於切割、鑽孔、碾磨和磨光等,一般大小不需要太大。大部分寶石級鑽石都可以用在工業上。鑽石可以鑲嵌在鑽頭或鋸子上,或磨成粉末後進行碾磨和磨光。[99]在專門用途上,鑽石可以作高壓實驗的器材(如鑽石對頂砧)、高效軸承以及特殊窗戶等。[100][101]在人工鑽石生產技術的發展下,更多應用將在未來實現,如作為集成電路中的半導體或電子產品中的散熱片等。[102]
安全
[编辑]純碳對人類的毒性很低,甚至可以以石墨或木炭的形式直接安全進食。碳可以抵抗化學侵蝕,包括消化道中的酸。因此當進入人體組織後,碳會長時間存留。炭黑有可能是第一種被用作紋身的顔料。冰人奧茨的身上有碳刺青,一直保留到他死後5200年後的今天。[103]然而,大量吸入煤灰或煤煙卻會刺激肺部,並造成煤工塵肺等阻塞性肺病。作磨料用的鑽石粉末在進食或吸入後同樣會造成危險。柴油引擎排煙中含有碳微粒,這些微粒會在肺部積聚。[104]如果進入身體的含碳物質還有其他的雜質,如有機化合物和重金屬等,就有可能會對身體造成額外的傷害。
碳對大部分地球生物來說毒性都很低,但對某些生物卻有毒。比如,碳納米微塵對果蠅屬是有毒的。[105]
碳在高溫下能在空氣中劇烈燃燒,如溫斯喬火災就是因加熱的石墨造成的。大量煤炭在無氧狀態下經過數億年後,首次被挖出時,可能會在接觸到空氣後自燃。
碳的眾多化合物中,有著多種劇毒,如河豚毒素、蓖麻毒蛋白、氰化物()和一氧化碳。
碳與各元素鍵合
[编辑]參見
[编辑]参考文献
[编辑]- ^ Prohaska, Thomas; Irrgeher, Johanna; Benefield, Jacqueline; Böhlke, John K.; Chesson, Lesley A.; Coplen, Tyler B.; Ding, Tiping; Dunn, Philip J. H.; Gröning, Manfred; Holden, Norman E.; Meijer, Harro A. J. Standard atomic weights of the elements 2021 (IUPAC Technical Report). Pure and Applied Chemistry. 2022-05-04. ISSN 1365-3075. doi:10.1515/pac-2019-0603 (英语).
- ^ History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky. Caer.uky.edu. [2008-09-12]. (原始内容存档于2012-11-01).
- ^ 3.0 3.1 Senese, Fred. Who discovered carbon?. Frostburg State University. 2007-09-09 [2007-11-24]. (原始内容存档于2007-12-07).
- ^ Lide, D. R. (编), CRC Handbook of Chemistry and Physics 86th, Boca Raton (FL): CRC Press, 2005, ISBN 0-8493-0486-5
- ^ 5.0 5.1 Haaland, D. Graphite-liquid-vapor triple point pressure and the density of liquid carbon. Carbon. 1976, 14 (6): 357. doi:10.1016/0008-6223(76)90010-5.
- ^ 6.0 6.1 Savvatimskiy, A. Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003). Carbon. 2005, 43 (6): 1115. doi:10.1016/j.carbon.2004.12.027.
- ^ Fourier Transform Spectroscopy of the System of CP (PDF). [2007-12-06]. (原始内容 (PDF)存档于2008-02-16).
- ^ Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical (PDF). [2007-12-06]. (原始内容 (PDF)存档于2008-02-16).
- ^ Carbon: Binary compounds. [2007-12-06]. (原始内容存档于2007-11-25).
- ^ Magnetic susceptibility of the elements and inorganic compounds 互联网档案馆的存檔,存档日期2012-01-12., in Handbook of Chemistry and Physics 81st edition, CRC press.
- ^ 11.0 11.1 11.2 11.3 11.4 Properties of diamond (页面存档备份,存于互联网档案馆), Ioffe Institute Database
- ^ 12.0 12.1 12.2 Carbon – Naturally occurring isotopes. WebElements Periodic Table. [2008-10-09]. (原始内容存档于2008-09-08).
- ^ History of Carbon. [2013-01-10]. (原始内容存档于2012-11-01).
- ^ 14.0 14.1 World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE). [2008-10-09]. (原始内容存档于2008-10-05).
- ^ 15.0 15.1 Chemistry Operations. Carbon. Los Alamos National Laboratory. 2003-12-15 [2008-10-09]. (原始内容存档于2008-09-13).
- ^ Biological Abundance of Elements. The Internet Encyclopedia of Science. [2008-10-09]. (原始内容存档于2012-02-04).
- ^ Greenville Whittaker, A. The controversial carbon solid−liquid−vapour triple point. Nature. 1978, 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ^ Zazula, J. M. On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam (PDF). CERN. 1997 [2009-06-06]. (原始内容存档 (PDF)于2009-03-25).
- ^ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene. Science. 2008, 321 (5887): 385–8. Bibcode:2008Sci...321..385L. PMID 18635798. doi:10.1126/science.1157996. 简明摘要.
- ^ Sanderson, Bill. Toughest Stuff Known to Man : Discovery Opens Door to Space Elevator. nypost.com. 2008-08-25 [2008-10-09]. (原始内容存档于2008-09-06).
- ^ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi. Materials: Ultrahard polycrystalline diamond from graphite. Nature. 2003, 421 (6923): 599–600. PMID 12571587. doi:10.1038/421599b.
- ^ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny. Superlubricity of Graphite (PDF). Physical Review Letters. 2004, 92 (12) [2013-07-29]. doi:10.1103/PhysRevLett.92.126101. (原始内容存档 (PDF)于2013-12-24).
- ^ Collins, A.T. The Optical and Electronic Properties of Semiconducting Diamond. Philosophical Transactions of the Royal Society A. 1993, 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ^ Deprez, N.; McLachan, D. S. The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction. Journal of Physics D: Applied Physics (Institute of Physics). 1988, 21 (1): 101. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ^ Delhaes, P. Graphite and Precursors. CRC Press. 2001. ISBN 90-5699-228-7.
- ^ 26.0 26.1 26.2 Unwin, Peter. Fullerenes(An Overview). [2007-12-08]. (原始内容存档于2007-12-01).
- ^ 27.0 27.1 Ebbesen, T. W. (编). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. 1997. ISBN 0-8493-9602-6.
- ^ 28.0 28.1 Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph. (编). Carbon nanotubes: synthesis, structures, properties and applications. Topics in Applied Physics (Berlin: Springer). 2001, 80. ISBN 3-540-41086-4.
- ^ 29.0 29.1 Nasibulin, Albert G.; Pikhitsa, P.V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A.V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; et al. A novel hybrid carbon material. Nature Nanotechnology. 2007, 2 (3): 156–161. Bibcode:2007NatNa...2..156N. PMID 18654245. doi:10.1038/nnano.2007.37.
- ^ Nasibulin, A; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. Investigations of NanoBud formation. Chemical Physics Letters. 2007, 446: 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ^ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong. Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst. Applied Catalysis A. 2004, 274: 1–8. doi:10.1016/j.apcata.2004.04.008.
- ^ 32.0 32.1 Clifford, Frondel; Marvin, Ursula B. Lonsdaleite, a new hexagonal polymorph of diamond. Nature. 1967, 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038/214587a0.
- ^ 33.0 33.1 33.2 Harris, PJF. Fullerene-related structure of commercial glassy carbons (PDF). Philosophical Magazine. 2004, 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. doi:10.1080/14786430410001720363. (原始内容 (PDF)存档于2012-03-19).
- ^ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. Structural analysis of a carbon foam formed by high pulse-rate laser ablation. Applied Physics A-Materials Science & Processing. 1999, 69 (7): S755–S758. doi:10.1007/s003390051522.
- ^ 35.0 35.1 35.2 Heimann, Robert Bertram; Evsyukov, Sergey E. and Kavan, Ladislav. Carbyne and carbynoid structures. Springer. 1999-02-28: 1– [2011-06-06]. ISBN 978-0-7923-5323-2. (原始内容存档于2012-11-23).
- ^ Jenkins, Edgar. The polymorphism of elements and compounds. Taylor & Francis. 1973: 30 [2011-05-01]. ISBN 0-423-87500-0. (原始内容存档于2012-11-23).
- ^ Schewe, Phil and Stein, Ben. Carbon Nanofoam is the World's First Pure Carbon Magnet. Physics News Update. 2004-03-26, 678 (1) [2013-07-29]. (原始内容存档于2012-03-07).
- ^ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu. Harder than Diamond: Determining the Cro]tional Area and Young's Modulus of Molecular Rods. Angew. Chem. Int. Ed. 2005, 44 (45): 7432–5. PMID 16240306. doi:10.1002/ange.200502448.
- ^ Mark, Kathleen. Meteorite Craters. University of Arizona Press. 1987. ISBN 0-8165-0902-6.
- ^ "Wonderfuel: Welcome to the age of unconventional gas" (页面存档备份,存于互联网档案馆) by Helen Knight, New Scientist, 12 June 2010, pp. 44–7.
- ^ Ocean methane stocks 'overstated' (页面存档备份,存于互联网档案馆), BBC, 17 Feb. 2004.
- ^ "Ice on fire: The next fossil fuel" (页面存档备份,存于互联网档案馆) by Fred Pearce, New Scientist, 27 June 2009, pp. 30-33.
- ^ Calculated from file global.1751_2008.csv in [1] (页面存档备份,存于互联网档案馆) from the Carbon Dioxide Information Analysis Center.
- ^ Kasting, James. The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning. Consequences: the Nature and Implication of Environmental Change. 1998, 4 (1) [2013-07-29]. (原始内容存档于2008-10-24).
- ^ Carbon-14 formation. [2013-07-29]. (原始内容存档于2015-08-01).
- ^ Gannes, Leonard Z.; Del Rio, Carlos Martı́nez; Koch, Paul. Natural Abundance Variations in Stable Isotopes and their Potential Uses in Animal Physiological Ecology. Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology. 1998, 119 (3): 725–737. doi:10.1016/S1095-6433(98)01016-2.
- ^ Official SI Unit definitions. [2007-12-21]. (原始内容存档于2007-10-14).
- ^ Brown, Tom. Carbon Goes Full Circle in the Amazon. Lawrence Livermore National Laboratory. 2006-03-01 [2007-11-25]. (原始内容存档于2008-09-22).
- ^ Bowman, S. Interpreting the past: Radiocarbon dating. British Museum Press. 1990. ISBN 0-7141-2047-2.
- ^ Libby, W. F. Radiocarbon dating. Chicago University Press and references therein. 1952.
- ^ Westgren, A. The Nobel Prize in Chemistry 1960. Nobel Foundation. 1960 [2007-11-25]. (原始内容存档于2007-10-25).
- ^ Kondev, F. G.; Wang, M.; Huang, W. J.; Naimi, S.; Audi, G. The NUBASE2020 evaluation of nuclear properties (PDF). Chinese Physics C. 2021, 45 (3): 030001. doi:10.1088/1674-1137/abddae.
- ^ Watson, A. Beaming Into the Dark Corners of the Nuclear Kitchen. Science. 1999, 286 (5437): 28–31 [2013-07-29]. doi:10.1126/science.286.5437.28. (原始内容存档于2020-06-12).
- ^ Audi, G; Bersillon, O.; Blachot, J.; Wapstra, A.H. The Nubase evaluation of nuclear and decay properties (PDF). Nuclear Physics A. 1997, 624: 1. Bibcode:1997NuPhA.624....1A. doi:10.1016/S0375-9474(97)00482-X. (原始内容 (PDF)存档于2011-09-28).
- ^ Ostlie, D.A. and Carroll, B.W. An Introduction to Modern Stellar Astrophysics. Addison Wesley, San Francisco. 2007. ISBN 0-8053-0348-0.
- ^ Whittet, D. C. B. Dust in the Galactic Environment. CRC Press. 2003: 45–46. ISBN 0-7503-0624-6.
- ^ Pikelʹner, Solomon Borisovich. Star formation. Springer. 1977: 38– [2011-06-06]. ISBN 978-90-277-0796-3. (原始内容存档于2012-11-23).
- ^ Falkowski, P; Scholes, RJ; Boyle, E; Canadell, J; Canfield, D; Elser, J; Gruber, N; Hibbard, K; et al. The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System. Science. 2000, 290 (5490): 291–296. Bibcode:2000Sci...290..291F. PMID 11030643. doi:10.1126/science.290.5490.291.
- ^ Smith, T. M.; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. The global terrestrial carbon cycle. Water, Air, & Soil Pollution. 1993, 70: 19–37. doi:10.1007/BF01104986.
- ^ Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali. The prebiological paleoatmosphere: stability and composition. Origins of Life and Evolution of Biospheres. 1982, 12 (3): 245–259. Bibcode:1982OrLi...12..245L. doi:10.1007/BF00926894.
- ^ Loerting, T.; et al. On the Surprising Kinetic Stability of Carbonic Acid. Angew. Chem. Int. Ed. 2001, 39 (5): 891–895. PMID 10760883. doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E.
- ^ Haldane J. The action of carbonic oxide on man. Journal of Physiology. 1895, 18 (5–6): 430–462. PMC 1514663
 . PMID 16992272.
. PMID 16992272.
- ^ Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. The clinical toxicology of carbon monoxide. Toxicology. 2003, 187 (1): 25–38. PMID 12679050. doi:10.1016/S0300-483X(03)00005-2.
- ^ Compounds of carbon: carbon suboxide. [2007-12-03]. (原始内容存档于2007-12-07).
- ^ Bayes, K. Photolysis of Carbon Suboxide. Journal of the American Chemical Society. 1961, 83 (17): 3712–3713. doi:10.1021/ja01478a033.
- ^ Anderson D. J.; Rosenfeld, R. N. Photodissociation of Carbon Suboxide. Journal of Chemical Physics. 1991, 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121.
- ^ Sabin, J. R.; Kim, H. A theoretical study of the structure and properties of carbon trioxide. Chemical Physics Letters. 1971, 11 (5): 593–597. Bibcode:1971CPL....11..593S. doi:10.1016/0009-2614(71)87010-0.
- ^ Moll N. G., Clutter D. R., Thompson W. E. Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2. Journal of Chemical Physics. 1966, 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.
- ^ 69.0 69.1 Fatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol) (PDF). Journal of Research of the National Bureau of Standards A: Physics and Chemistry. 1963, 67A (2): 153–162. doi:10.6028/jres.067A.015. (原始内容 (PDF)存档于2009年3月25日).
- ^ Pauling, L. The Nature of the Chemical Bond 3rd. Ithaca, NY: Cornell University Press. 1960: 93. ISBN 0-8014-0333-2.
- ^ Wright, David. Translating Science: The Transmission of Western Chemistry into Late Imperial China, 1840–1900. 2000. ISBN 978-9004117761.
- ^ Shorter Oxford English Dictionary, Oxford University Press
- ^ Chinese made first use of diamond. BBC News. 2005-05-17 [2007-03-21]. (原始内容存档于2007-03-20).
- ^ van der Krogt, Peter. Carbonium/Carbon at Elementymology & Elements Multidict. [2010-01-06]. (原始内容存档于2010-01-23).
- ^ Ferchault de Réaumur, R-A. L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956). Paris, Chicago. 1722.
- ^ Carbon. Canada Connects. [2010-12-07]. (原始内容存档于2010-10-27).
- ^ Senese, Fred. Who discovered carbon?. Frostburg State University. [2007-11-24]. (原始内容存档于2007-12-07).
- ^ Giolitti, Federico. The Cementation of Iron and Steel. McGraw-Hill Book Company, inc. 1914.
- ^ Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. C60: Buckminsterfullerene. Nature. 1985, 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0.
- ^ The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes". [2007-12-21]. (原始内容存档于2013-06-22).
- ^ 81.0 81.1 81.2 USGS Minerals Yearbook: Graphite, 2009 (页面存档备份,存于互联网档案馆) and Graphite: Mineral Commodity Summaries 2011
- ^ Harlow, G. E. The nature of diamonds. Cambridge University Press. 1998: 223. ISBN 0-521-62935-7.
- ^ Catelle, W.R. The Diamond. John Lane Company. 1911. Page 159 discussion on Alluvial diamonds in India and elsewhere as well as earliest finds
- ^ Ball, V. Diamonds, Gold and Coal of India. London, Truebner & Co. 1881. Ball was a Geologist in British service. Chapter I, Page 1
- ^ Hershey, J. W. The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture. Kessinger Pub Co. 1940: 28. ISBN 1-4179-7715-9.
- ^ Janse, A. J. A. Global Rough Diamond Production Since 1870. Gems and Gemology (GIA). 2007, XLIII (Summer 2007): 98–119. doi:10.5741/GEMS.43.2.98.
- ^ 87.0 87.1 Lorenz, V. Argyle in Western Australia: The world's richest diamantiferous pipe; its past and future. Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft (DGemG). 2007, 56 (1/2): 35–40.
- ^ Microscopic diamond found in Montana. The Montana Standard. 2004-10-17 [2008-10-10]. (原始内容存档于2005-01-21).
- ^ Marshall, Stephen; Shore, Josh. The Diamond Life. Guerrilla News Network. 2004-10-22 [2008-10-10]. (原始内容存档于2008-06-09).
- ^ 存档副本 (PDF). [2020-08-20]. (原始内容存档 (PDF)于2020-08-20).
- ^ Cantwell, W. J.; Morton, J. The impact resistance of composite materials – a review. Composites. 1991, 22 (5): 347–62. doi:10.1016/0010-4361(91)90549-V.
- ^ Prekob, Ádám; Hajdu, Viktória; Muránszky, Gábor; Kocserha, István; Fiser, Béla; Viskolcz, Béla; Vanyorek, László. Application of carbonized ion exchange resin beads as catalyst support for gas phase hydrogenation processes. Reaction Kinetics, Mechanisms and Catalysis (Springer Science and Business Media LLC). 2019-11-02, 129 (1): 85–94. ISSN 1878-5190. doi:10.1007/s11144-019-01694-7.
- ^ Sikora, Emőke; Kiss, Adrienn; H. Göndör, Zsuzsa; Pekker, Péter; Kristály, Ferenc; Szőri, Milán; Rágyanszki, Anita; Viskolcz, Béla; Fiser, Béla; Vanyorek, László. Fine-tuning the catalytic activity by applying nitrogen-doped carbon nanotubes as catalyst supports for the hydrogenation of olefins. Reaction Kinetics, Mechanisms and Catalysis (Springer Science and Business Media LLC). 2019-12-14, 129 (1): 95–106. ISSN 1878-5190. doi:10.1007/s11144-019-01705-7.
- ^ Pangotra, Dhananjai; Csepei, Lénárd-István; Roth, Arne; Ponce de León, Carlos; Sieber, Volker; Vieira, Luciana. Anodic production of hydrogen peroxide using commercial carbon materials. Applied Catalysis B: Environmental (Elsevier BV). 2022, 303: 120848. ISSN 0926-3373. doi:10.1016/j.apcatb.2021.120848.
- ^ Perry, Samuel C.; Pangotra, Dhananjai; Vieira, Luciana; Csepei, Lénárd-István; Sieber, Volker; Wang, Ling; Ponce de León, Carlos; Walsh, Frank C. Electrochemical synthesis of hydrogen peroxide from water and oxygen. Nature Reviews Chemistry (Springer Science and Business Media LLC). 2019-06-19, 3 (7): 442–458. ISSN 2397-3358. doi:10.1038/s41570-019-0110-6.
- ^ Duan, Weijian; Li, Ge; Lei, Zhenchao; Zhu, Tonghe; Xue, Yuzhou; Wei, Chaohai; Feng, Chunhua. Highly active and durable carbon electrocatalyst for nitrate reduction reaction. Water Research (Elsevier BV). 2019, 161: 126–135. ISSN 0043-1354. doi:10.1016/j.watres.2019.05.104.
- ^ Holtzapffel, Ch. Turning And Mechanical Manipulation. Charles Holtzapffel. 1856 [2013-07-29]. (原始内容存档于2013-06-20). Internet Archive (页面存档备份,存于互联网档案馆)
- ^ Industrial Diamonds Statistics and Information. United States Geological Survey. [2009-05-05]. (原始内容存档于2009-05-06).
- ^ Coelho, R. T.; Yamada, S.; Aspinwall, D.K.; Wise, M.L.H. The application of polycrystalline diamond (PCD) tool materials when drilling and reaming aluminum-based alloys including MMC. International journal of machine tools & manufacture. 1995, 35 (5): 761. doi:10.1016/0890-6955(95)93044-7.
- ^ Harris, D. C. Materials for infrared windows and domes: properties and performance. SPIE Press. 1999: 303–334. ISBN 0-8194-3482-5.
- ^ Nusinovich, G. S. Introduction to the physics of gyrotrons. JHU Press. 2004: 229. ISBN 0-8018-7921-3.
- ^ Sakamoto, M.; Endriz, J. G.; Scifres, D. R. 120 W CW output power from monolithic AlGaAs (800 nm) laser diode array mounted on diamond heatsink. Electronics Letters. 1992, 28 (2): 197–199. doi:10.1049/el:19920123.
- ^ Dorfer, Leopold; Moser, M; Spindler, K; Bahr, F; Egarter-Vigl, E; Dohr, G. 5200-year old acupuncture in Central Europe?. Science. 1998, 282 (5387): 242–243. Bibcode:1998Sci...282..239D. PMID 9841386. doi:10.1126/science.282.5387.239f.
- ^ Donaldson, K; Stone, V; Clouter, A; Renwick, L; MacNee, W. Ultrafine particles. Occupational and Environmental Medicine. 2001, 58 (3): 211–216 [2013-07-29]. PMC 1740105
 . PMID 11171936. doi:10.1136/oem.58.3.211. (原始内容存档于2009-05-01).
. PMID 11171936. doi:10.1136/oem.58.3.211. (原始内容存档于2009-05-01).
- ^ Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To Young (页面存档备份,存于互联网档案馆) ScienceDaily (Aug. 17, 2009)
外部連結
[编辑]- 元素碳在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 碳(英文)
- 元素碳在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素碳在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 碳(英文)
- Carbon (页面存档备份,存于互联网档案馆) at The Periodic Table of Videos(諾丁漢大學)
- 大英百科全書:碳 (页面存档备份,存于互联网档案馆)
- 碳在電化學中的應用
































