生物等效性
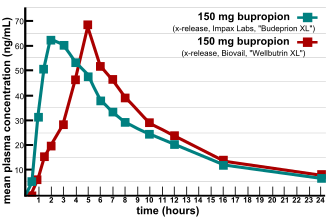
生物等效性或生物等效(英文:Bioequivalence,简称BE)是药代动力学的术语,用于评估同一药物的两种制剂产品,其预期的体内生物活性是否等效。若两种药物制剂是生物等效的,则它们的所有治疗意图与治疗作用一致。
药剂等效性(Pharmaceutical equivalent),或称药学等效性是指:给予患者同一剂量的同一活性成分(非活性成分可不同),且使用同一剂型和相同的给药途径下,可满足相同或与之相当的药品标准。而生物等效性可定义为:若两种药品存在药剂等效,给予了相同的摩尔剂量药物后,因生物利用度(利用率和利用程度)相似以致两者在疗效与安全性上均相似,则认为两种药品是生物等效。[1][2]
世界卫生组织(WHO)对生物等效性的定义为:若两种药品为药学等效物或药物替代物(Pharmaceutical alternative),则患者在相同条件下且等摩尔剂量给药,其生物利用度包括药代动力学速率(参数Cmax和tmax)和吸收程度(参数曲线下面积)等参数均一致,则药物彼此间是生物等效的。[3][4][5]
美国食品和药物管理局(FDA)将生物等效性定义为:一项适当设计的研究中,在相似条件和等摩尔剂量给予药学等效物或药物替代物,其中的药物活性成分作用于目标部位,且作用的速率和程度在统计学上不存在显着差异。[6]
生物等效
[编辑]研究两种产品是否存在生物等效性,需进行药代动力学研究,如比较待审批仿制药与已上市药物之间是否存在生物等效性。其中药代动力学研究可通过交叉研究试验进行,即分别将让志愿受试者服用不同的制剂进行比较研究。此时受试者中通常为健康受试者,偶尔也会纳入患者进行该项试验。研究期间需定期采取受试者的血清或血浆样本,测定母体药物或药物代谢物的浓度。若血药浓度水平太低导致无法通过检测比较,如吸入皮质类固醇药物,则选择药效终点代替药代动力学终点进行比较。药代动力学涉及血浆浓度数据,以评估关键的药代动力学参数如:曲线下面积(AUC)、血药峰浓度(Cmax)、达峰浓度时间(Tmax)和吸收滞后时间(tlag)。应在几种不同的剂量下进行测试,尤其当药物表现出非线性药代动力学时。[7]
除生物等效性研究数据之外,还需提交满足生物等效性的监管要求的其他数据,可能包括:
- 分析方法验证数据
- 体内–体外相关性研究数据(IVIVC)
监管机构定义
[编辑]世界卫生组织
[编辑]世界卫生组织(WHO)定义:若多个来源的仿制药产品与比较药(Comparator),其AUC0–t和Cmax的比值的90%置信区间均位于80.00-125.00%的可接受范围内,则两种制剂为生物等效。对于高变量的成品药,Cmax的可接受范围为69.84-143.19%。[8]
澳大利亚
[编辑]澳大利亚的监管机构治疗产品管理局(Therapeutics Good Administration,TGA)定义:若两种制剂之间的Cmax和AUC比例的90%置信区间(90% CI)在 0.80-1.25范围内,则认为制剂具有生物等效性。产品之间的Tmax也应相似。[1]
对治疗指数窄和/或代谢饱和的药物,澳大利亚的监管有更严格的要求,因此澳市场上不允许地高辛或苯妥英等仿制药上市。
欧洲
[编辑]根据欧洲经济区[9]适用的法规:如若两种药品为药物等效物或药物替代物,在相同摩尔剂量给药后,其生物利用度相似即疗效和安全性均相同,则两种药品是生物等效的。这意味着,若两种制剂的AUC0-t和Cmax比例的 90%置信区间(90% CI)在80-125%范围内,则认为可证明为生物等效。
美国
[编辑]美国FDA定义:若待测试药物制剂(Test fomulation)如仿制药与对照药物制剂(Reference formulation)如原研药,其Cmax、AUC(0–t)和AUC(0–∞)等参数的相对平均值的90% CI在空腹状态下为80%至125%的范围内,则认为两种药物生物等效。尽管有个别例外,但通常两者的比较也需比较饮食前后对于给药的影响,即所谓的“进食研究”或“食物效应研究”。食物效应研究需要与上述禁食研究进行相同的统计评估。[6]
中国
[编辑]
中国在2016年前缺乏生物等效性的要求。2016年的《关于开展仿制药质量和疗效一致性评价的意见》确立了生物等效性工作的基础。2020年7月后的新仿制药必须经过生物等效性评价;此前批准的,未经评价的药物可以额外申请评价。2019年开始,国家带量采购以通过“仿制药一致性评价”作为投标标准之一。[11]
2020年5月给出的“生物等效性”的条件为仿制药和参照药物的Cmax、AUC(0–t)和AUC(0–∞)等参数的几何平均值在空腹和进食状态下为80%至125%的范围内。为了避免仿制药以仿制药作为参照,偏离原研药的异常情况,国家药监局要求首选原研药作为参考药物,如由于停产等原因无原研药可用的则优先选择发达国家批准的、国际公认的仿制药,如无再使用中国批准的、国际公认的仿制药。不能使用药代数据的剂型(如口服不吸收的药物)可以使用量效曲线比较。[11]
Wei等(2022)发现,一致性评价导致药企增加了研发投入,对私企和高收益企业更加如此。[12]Liu等(2023)认为,仿制药一致性评价系统提升了中国药企的创新质量。[13]
生物等效的诸多问题
[编辑]FDA坚持认为批准的仿制药与原研药等效,然而有许多案例报道了医生与患者反映一些药物存在生物等效性问题。[14]某些类型药物因特殊的化学性质而被特别关注是否存在问题,包括手性药物、吸收差的药物和细胞毒性药物。此外,复杂的递送机制可能会导致生物等效性存在差异。[14]医生在抗癫痫药、华法林和左旋甲状腺素开具处方时,会避免将原研药换为仿制药给予患者,或在不同制药公司的仿制药之间切换药物。[15]
由于FDA批准的多个仿制药在疗效和副作用性质方面不相同,导致一段时间的生物等效性验证方面状况频发。[16]2007年,两家营养品和营养补充剂消费者信息公司公布了不同品牌的安非他酮的比较测试结果。[17]其中多份报告称,安非他酮仿制药的副作用较原研药物增加且疗效下降,这促使他们对有问题的产品进行比较测试。 在实验室中测试表明,某些仿制药安非他酮(Wellbutrin XL)300 mg规格的药物疗效不及原研药(Budeprion XL)。[18]FDA对以上投诉进行调查并得出结论:安非他酮及其主要活性代谢产物羟基安非他酮的生物利用度方面,仿制药相当于原研药物。 FDA还表示:当患者从仿制药切换至原研药时,抑郁症恶化的情况,归咎于自然情绪变化的某种巧合。[19]然而经过几年的否认患者报告,于2012年FDA推翻原论断,宣布仿制药Budeprion XL 300 mg未能证明与原研药Wellbutrin XL 300 mg存在治疗等效性。[20]FDA未测试其他安非他酮仿制药的生物等效性,但要求四家药品制造商于2013年3月之前向FDA提交有关问题的数据。截至2013年10月,FDA已经对某些制造商生产的制剂产品做出了不具有生物等效性的决定。[21]
2004年,印度兰伯西实验室被揭露其生产的仿制药数据存在伪造的事实。结果其30种相关产品从美国市场撤出,兰伯西实验室支付了5亿美元的罚款。东窗事发后,FDA对多家印度药厂进行了调查,导致至少有12家有关公司的药品被禁止进入美国市场。 [15]
2017年,由于检查发现印度微型治疗研究实验室(Micro Therapeutic Research Lab)的研究中存在虚假数据且文件和数据处理方面存在缺陷,欧洲药品管理局建议暂停受理一系列由该公司进行生物等效性研究的相关国家批准药物[22]
参见
[编辑]参考资料
[编辑]- ^ 1.0 1.1 Birkett DJ. Generics - equal or not?. Australian Prescriber. 1 August 2003, 26 (4): 85–87. doi:10.18773/austprescr.2003.063
 .
.
- ^ Shargel, L.; Yu, A.B. Applied biopharmaceutics & pharmacokinetics 4th ed. New York: McGraw-Hill. 1999. ISBN 978-0-8385-0278-5.
- ^ WHO Guidance for organizations performing in vivo bioequivalence studies. (PDF). WHO Technical Report Series No. 996, Annex 9 (报告) (World Health Organization). 2016 [2023-06-26]. (原始内容存档 (PDF)于2022-03-08).
- ^ Tracy TS. Modern pharmacology with clinical applications. Hagerstwon, MD: Lippincott Williams & Wilkins. 2004: 49. ISBN 0-7817-3762-1.
- ^ Maurer, Hans H. Multi-analyte procedures for screening for and quantification of drugs in blood, plasma, or serum by liquid chromatography-single stage or tandem mass spectrometry (LC-MS or LC-MS/MS) relevant to clinical and forensic toxicology. Clinical Biochemistry (Elsevier BV). 2005, 38 (4): 310–318. ISSN 0009-9120. PMID 15766732. doi:10.1016/j.clinbiochem.2005.01.014.
- ^ 6.0 6.1 Center for Drug Evaluation and Research. Guidance for Industry: Bioavailability and Bioequivalence Studies for Orally Administered Drug Products – General Considerations (PDF). United States Food and Drug Administration. 2003 [2023-06-26]. (原始内容存档 (PDF)于2017-06-23).Center for Drug Evaluation and Research (2003). "Guidance for Industry: Bioavailability and Bioequivalence Studies for Orally Administered Drug Products – General Considerations" (页面存档备份,存于互联网档案馆) (PDF). United States Food and Drug Administration.
- ^ Gabrielsson J, Weiner D (2006) Pharmacokinetic and pharmacodynamic data analysis: concepts and applications, 4th edn. Swedish Pharmaceutical Press, Stockholm
- ^ WHO guidelines on Multisource (generic) pharmaceutical products: guidelines on registration requirements to establish interchangeability WHO Technical Report Series, No. 1003, 2017, Annex 6 (PDF). [2023-06-26]. (原始内容存档 (PDF)于2022-03-31).
- ^ Committee for Medicinal Products for Human Use. Guideline on the Investigation of Bioequivalence (PDF). European Medicines Agency. 20 January 2010 [21 April 2011]. (原始内容存档 (PDF)于2018-06-14).
- ^ 总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号). nmpa.gov.cn. [18 September 2024].
- ^ 11.0 11.1 苏华; 郭瑞臣. 仿制药一致性评价的背景、实施及结局. 中国医院药学杂志. 2022, 42 (14) [2024-06-18]. doi:10.13286/j.1001-5213.2022.14.21. (原始内容存档于2024-06-18).
- ^ Wei, Y; Zhu, J; Qiao, J; Zhang, D; Chen, Y; Suchecki, S. The Impact of the Consistency Evaluation Policy of Generic Drugs on R&D Investment Intensity of Pharmaceutical Companies-An Empirical Study Based on the Difference-in-Differences Model.. Frontiers in public health. 2022, 10: 902025. PMC 9218526
 . PMID 35757628. doi:10.3389/fpubh.2022.902025.
. PMID 35757628. doi:10.3389/fpubh.2022.902025.
- ^ Liu, Q; Huang, Z; Mao, Z. Has the consistency evaluation policy of generic drugs promoted the innovation quality of Chinese pharmaceutical manufacturing industry? An empirical study based on the difference-in-differences model.. Frontiers in public health. 2023, 11: 1265756. PMC 10722264
 . PMID 38106910. doi:10.3389/fpubh.2023.1265756.
. PMID 38106910. doi:10.3389/fpubh.2023.1265756.
- ^ 14.0 14.1 Midha KK, McKay G. Bioequivalence; its history, practice, and future. The AAPS Journal. December 2009, 11 (4): 664–70. PMC 2782076
 . PMID 19806461. doi:10.1208/s12248-009-9142-z.
. PMID 19806461. doi:10.1208/s12248-009-9142-z.
- ^ 15.0 15.1 Bate R, Mathur A, Lever HM, Thakur D, Graedon J, Cooperman T, et al. Generics Substitution, Bioequivalence Standards, and International Oversight: Complex Issues Facing the FDA. Trends in Pharmacological Sciences. March 2016, 37 (3): 184–191. PMID 26687297. doi:10.1016/j.tips.2015.11.005.
- ^ 存档副本. [2023-06-26]. (原始内容存档于2023-06-26).
- ^ Generic drug equality questioned. [13 October 2007]. (原始内容存档于20 October 2012).
- ^ Stenson J. Report questions generic antidepressant. NBC News. 12 October 2007 [13 October 2007]. (原始内容存档于2013-10-11).
- ^ Review of therapeutic equivalence: generic bupropion XL 300 mg and Wellbutrin XL 300 mg. Food and Drug Administration. [19 April 2008]. (原始内容存档于6 June 2011).
- ^ Budeprion XL 300 mg not therapeutically equivalent to Wellbutrin XL 300 mg (新闻稿). FDA. 3 October 2012 [23 March 2013]. (原始内容存档于2019-04-24).
- ^ FDA Update. FDA. October 2013 [15 June 2015]. (原始内容存档于2019-04-24).
- ^ EMA recommends suspension of medicines due to unreliable studies from Micro Therapeutic Research Labs. European Medicines Agency. 2017-03-24 [2020-11-17]. (原始内容存档于2020-10-26).
外部链接
[编辑]- Hussain AS, et al. The Biopharmaceutics Classification System: Highlights of the FDA's Draft Guidance (页面存档备份,存于互联网档案馆) Office of Pharmaceutical Science, Center for Drug Evaluation and Research, Food and Drug Administration.
- Mills D (2005). Regulatory Agencies Do Not Require Clinical Trials To Be Expensive International Biopharmaceutical Association: IBPA Publications.
- FDA CDER Office of Generic Drugs – further U.S. information on bioequivalence testing and generic drugs
- Proposal to waive in vivo bioequivalence requirements for WHO Model List of Essential Medicines immediate-release, solid oral dosage forms (页面存档备份,存于互联网档案馆). WHO Technical Report Series, No. 937, 2006, Annex 8.
- Guidance for organizations performing in vivo bioequivalence studies (revision) (页面存档备份,存于互联网档案馆). WHO Technical Report Series 996, 2016, Annex 9.
- General background notes and list of international comparator pharmaceutical products (页面存档备份,存于互联网档案馆). WHO Technical Report Series 1003, 2017, Annex 5.
- WHO List of International Comparator products (September 2016)
