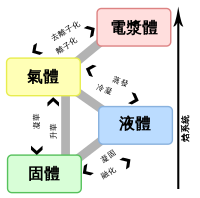
沸點

當液體的蒸氣壓與其環境中的氣壓相當,該環境溫度即為物質的「沸點」。[1][2] 液體的溫度達到沸點時會變成氣體。
液體的沸點取決於環境氣壓。當液體處於壓力低於一個大氣壓的環境時,沸點較低;反之液體處於高於一個大氣壓的環境時,沸點較高。舉例來説,水在海拔高度為0的地方時的沸點為100 °C(212 °F),在海拔高度為1,905米(6,250英尺)的地方則為93.4 °C(200.1 °F)[3] 定壓下,不同的液體會在不同的溫度下沸騰。
處於液體的「正常沸點」(另稱作「常壓沸點」)下,液體的蒸氣壓與一個標準大氣壓相等。[4][5] 在此溫度下,液體的蒸氣壓足以對抗大氣壓,並在液體內部形成蒸氣泡泡。1982年,IUPAC將「標準沸點」定義為一巴氣壓下液體沸騰的溫度。[6]
定壓下(通常為大氣壓),將定量(莫耳數、質量等)的物質從液體轉變成氣體所需的能量被稱為汽化熱。
液體也可以透過蒸發過程在溫度低於沸點的狀態下變成蒸氣。蒸發屬於表面現象,液體邊緣的分子受到的液體壓力較小,因此得以蒸氣的形式脫離到環境之中。不同於蒸發,沸騰時液體當中的任何分子皆可脫離到環境之中,並於液體內部形成蒸氣泡泡。
飽和溫度與飽和氣壓
[編輯]一個飽和液體在不沸騰的情況下儲存了最多熱能。對應的,飽和蒸氣在不凝結的情況下儲存了最少熱能。
飽和溫度即為沸點。飽和溫度為液體沸騰變成蒸氣時,對應飽和氣壓下的溫度。此時液體可被視為熱能飽和,一點熱能的變化就會導致相變。
若系統內的氣壓為一常數(即進行等壓過程),處於飽和溫度的蒸氣會開始凝結成液體,因為移除了額外熱能(熱量)。類似的,處於飽和溫度的液體會開始沸騰成蒸氣,因為給予了額外熱能。
沸點對應到蒸氣壓與環境氣壓相等時的溫度。因此,沸點與氣壓有着密切的關聯。沸點的參考氣壓為一個標準大氣壓,其中有NIST規定的101.325 kPa (1 atm),或是IUPAC規定的100.000 kPa。高度較高的地方,由於空氣較稀薄,氣壓相對地面低,因此物質的沸點也會比於地面測得的沸點低。沸點會隨着氣壓增加而升高,直到達到物質的臨界點,液體與氣體因表現性質變得相同而無法作出區別。沸點無法超越臨界點之上。另外,沸點會隨着氣壓減少而降低,直到達到物質的三相點。沸點亦無法降低到三相點之下。
若已知液體在某溫度的汽化熱與蒸氣壓,其沸點可以透過克勞修斯-克拉伯龍方程計算,其公式為:
其中
飽和氣壓為液體沸騰變成蒸氣時,對應飽和溫度下的氣壓。飽和氣壓與飽和溫度有着直接關係:二者會同時增加或減少。
若系統內的溫度為一常數(即進行等溫過程),處於飽和氣壓與飽和溫度的蒸氣會開始凝結成液體,因為系統氣壓增加。類似的,處於飽和氣壓的液體會開始閃蒸成蒸氣,因為系統氣壓減少。
現在有兩種對於「水的標準沸點」的定義。其中一個定義為其「正常沸點」,1 atm(101.325 kPa)氣壓下數值為99.97 °C(211.9 °F)。IUPAC 建議的定義則是 100 kPa(1 巴)[7] 的標準氣壓下,99.61 °C(211.3 °F)作為水的標準沸點。[6][8] 位於珠穆朗瑪峰上的 8,848米(29,029英尺)處,氣壓約為 34 kPa(255 Torr)[9],而水的沸點為71 °C(160 °F)。
1954年之前,攝氏溫標定義的兩個參考點為標準大氣壓下,以 0 °C 作為水的凝固點,100 °C 作為水的沸點。
正常沸點與液體蒸氣壓之間的關係
[編輯]
定溫下,液體的蒸氣壓越高,其正常沸點(即一個大氣壓下的沸點)越低。
右側的蒸氣壓-溫度圖表顯示了各種液體在不同溫度下的蒸氣壓數值。[10] 從圖表中可見,擁有較高蒸氣壓的液體同時也擁有較低的正常沸點。在圖表當中,正常沸點可以透過蒸氣壓-溫度曲線與縱軸標示一個大氣壓(1 atm)的蒸氣壓水平線所相交的點求得。舉例來説,在任意給定的溫度下,氯甲烷擁有圖表當中最大的蒸氣壓,同時也擁有最低的正常沸點(−24.2 °C)。
液體能夠沸騰的最大溫度(以及最大氣壓)被稱作臨界點。
關於水的特殊性質,可以參見水蒸氣壓。
元素性質
[編輯]氦擁有所有元素當中最低的沸點,數值為4.22 K。標準氣壓下,錸和鎢的沸點超過 5000 K;但由於精確測量高溫的難度較高,常帶有一定偏差,因此它們都被視為擁有最高的沸點。[11]
沸點作為純淨化合物的參考性質
[編輯]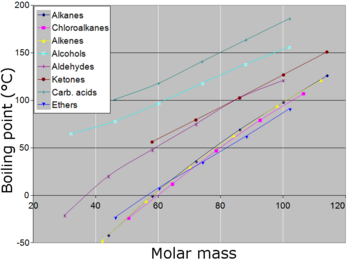
透過蒸氣壓-溫度圖表可推測純淨化合物的正常沸點, 並作為該化合物整體揮發性的依據參考數據。純淨化合物只會有一個正常沸點,因此化合物的正常沸點和正常熔點可以作為其特徵物理性質。物質的正常沸點越高,其整體揮發性越低;對應的,物質的正常沸點越低,化合物越容易揮發。一些物質在達到正常沸點之前,甚至是正常熔點之前就會因高溫而分解。穩定化合物的沸點總是介於其三相點與臨界點之前,並取決於外界氣壓。超越三相點,物質的正常沸點會高於正常熔點;超越臨界點,物質的液體與蒸氣狀態變成單一的狀態,被稱為「過熱蒸氣」。
任意給定溫度下,若化合物的沸點相對較低,則該化合物在常壓下將以氣體形式存在;若化合物的沸點相對較高,則該化合物在常壓下將以固體或液體的形式存在,揮發性物質的蒸氣可以與其保持相平衡。若揮發的蒸氣沒有被系統保留,這些物質有可能會完全揮發掉,雖然説它們的沸點比較高。
通常,具有離子鍵的化合物擁有較高的正常沸點。許多金屬擁有高沸點,但並非全部。在其他因素不變的情況下,以共價鍵結合分子的大小或分子量增加,其正常沸點也會升高。但是,當分子的大小足以形成高分子或聚合物時,經常會在未達到正常沸點之前就在高溫下分解。另一個影響正常沸點的因素是物質的極性。在其他因素不變的情況下正常沸點會隨着極性增加而升高。這是因為物質(多為液體)形成氫鍵的能力增強,使得分子需要提供更多能量才能脫離原本的狀態變成蒸氣,進而升高正常沸點。舉例來説,具有簡單結構的羧酸分子間會締合形成氫鍵,因此正常沸點較其他羧酸高。分子的形狀也會稍微影響物質的正常沸點。同一個分子,分子排列緊密會使沸點稍微降低,分子表面積越大則擁有較高的沸點。
| 常見名稱 | 正丁烷 | 異丁烷 |
|---|---|---|
| IUPAC 名稱 | 丁烷 | 2-甲基丙烷 |
| 分子結構 | 
|
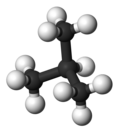
|
| 沸點(°C) | −0.5 | −11.7 |
| 常見名稱 | 正戊烷 | 異戊烷 | 新戊烷 |
|---|---|---|---|
| IUPAC 名稱 | 戊烷 | 2-甲基丁烷 | 2,2-二甲基丙烷 |
| 分子結構 | 
|

|

|
| 沸點(°C) | 36.0 | 27.7 | 9.5 |
大部分具有揮發性的化合物(接近環境溫度)在其固體加熱時短暫進入液體狀態,隨後變成蒸氣。與沸騰對比,升華是固體直接變成蒸氣的物理變化,如大氣壓下,乾冰直接變成二氧化碳。過程中,化合物的蒸氣壓與外界壓力相等時的溫度被稱作物質的升華點。
雜質與混合物
[編輯]
溶解在物質中的雜質或混溶物(溶質)會改變其蒸氣壓與沸點,改變的大小程度取決於溶質的濃度。不會揮發的不純物,如鹽,或是揮發性遠低於溶劑的物質會降低各成分的莫耳分數及其溶液的揮發性,因而提高正常沸點,且與溶質濃度成正比。這樣的效應被稱作沸點升高。常見的例子有,鹽水的沸點比純水高。
由混溶物組成的混合物中,可能存在揮發性不同的兩種(以上)的物質,並且各自擁有定壓下純態的沸點。具有揮發性的物質會改變混合物的蒸氣壓、沸點及露點。露點是蒸氣凝結變成液體的溫度。給定溫度下,混合物的蒸氣組成比例在大部分情況下皆與其液體狀態下的組成比例不同。這樣的差異可以透過沸點圖表示。液體-蒸氣的組成比例差異,使得重複的沸騰及冷凝過程得以分離不同物質。此流程被稱作蒸餾。
參見
[編輯]- 元素沸點列表
- 沸點升高
- 臨界溫度(熱力學)
- 沸點計,能夠精確測量液體沸點的儀器
- 赫格登溫度
- Joback 方法,透過分子結構預測正常沸點
- 氣體列表與其沸點
- 熔點
- 過冷
- 過熱
- 特魯頓規則,與沸點潛熱有關
- 三相點
參考書目
[編輯]- ^ Goldberg, David E. 3,000 Solved Problems in Chemistry 1st. McGraw-Hill. 1988. section 17.43, p. 321. ISBN 0-07-023684-4.
- ^ Theodore, Louis; Dupont, R. Ryan; Ganesan, Kumar (編). Pollution Prevention: The Waste Management Approach to the 21st Century. CRC Press. 1999. section 27, p. 15. ISBN 1-56670-495-2.
- ^ Boiling Point of Water and Altitude. www.engineeringtoolbox.com. [2022-03-27]. (原始內容存檔於2023-07-15).
- ^ General Chemistry Glossary (頁面存檔備份,存於互聯網檔案館) 普渡大學 website page
- ^ Reel, Kevin R.; Fikar, R. M.; Dumas, P. E.; Templin, Jay M. & Van Arnum, Patricia. AP Chemistry (REA) – The Best Test Prep for the Advanced Placement Exam 9th. Research & Education Association. 2006. section 71, p. 224. ISBN 0-7386-0221-3.
- ^ 6.0 6.1 Cox, J. D. Notation for states and processes, significance of the word standard in chemical thermodynamics, and remarks on commonly tabulated forms of thermodynamic functions. Pure and Applied Chemistry. 1982, 54 (6): 1239–1250. doi:10.1351/pac198254061239
 .
.
- ^ Standard Pressure (頁面存檔備份,存於互聯網檔案館) IUPAC defines the "standard pressure" as being 105 Pa (which amounts to 1 bar).
- ^ Appendix 1: Property Tables and Charts (SI Units) (頁面存檔備份,存於互聯網檔案館), Scroll down to Table A-5 and read the temperature value of 99.61 °C at a pressure of 100 kPa (1 bar). Obtained from McGraw-Hill's Higher Education website.
- ^ West, J. B. Barometric pressures on Mt. Everest: New data and physiological significance. Journal of Applied Physiology. 1999, 86 (3): 1062–6. PMID 10066724. doi:10.1152/jappl.1999.86.3.1062.
- ^ Perry, R.H.; Green, D.W. (編). Perry's Chemical Engineers' Handbook 7th. McGraw-Hill. 1997. ISBN 0-07-049841-5.
- ^ DeVoe, Howard. Thermodynamics and Chemistry 1st. Prentice-Hall. 2000. ISBN 0-02-328741-1.
外部連結
[編輯] Beach, Chandler B. (編). Boiling-Point. The New Student's Reference Work. Chicago: F. E. Compton and Co. 1914 (英語).
Beach, Chandler B. (編). Boiling-Point. The New Student's Reference Work. Chicago: F. E. Compton and Co. 1914 (英語).