內質網
| 細胞生物學 | |
|---|---|
| 動物細胞 | |

|
內質網(英語:Endoplasmic reticulum, ER)是在真核生物細胞中由膜圍成的隧道系統,為細胞中的重要胞器。實際上內質網是膜被摺疊成一個扁囊或細管狀構造,可分為粗糙內質網(Rough Endoplasmic Reticulum, RER)和光滑內質網一代(Smooth Endoplasmic Reticulum, SER)兩種。
內質網聯繫了細胞核、細胞質和細胞膜這幾大細胞構造。(它內與細胞核(核膜外膜)相連),但外部並不與細胞膜連接。內質網負責物質從細胞核到細胞質、細胞膜以及細胞外的轉運過程。因為細胞內質網膜與細胞核外膜是相連的,因此內質網空腔與核周腔(perinuclear space)是共通,且細胞可以靠內質網的膜來快速調節細胞核的大小。粗糙內質網上附著有大量核糖體,合成膜蛋白和分泌蛋白。光面內質網上無核糖體,為細胞內外醣類和脂類的合成和轉運場所。
這一結構由基思·R·波特、阿爾伯特·克勞德和Ernest F. Fullam在1945年時首先發現[1]。
結構
[編輯]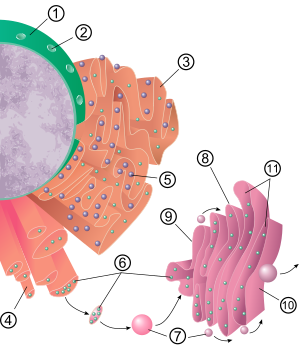
內質網的大體結構是由細胞骨架支撐的囊結構。它的內層與核膜相連,由磷脂雙分子層形成一個獨立於細胞質基質封閉的空間。
粗糙內質網
[編輯]在病理狀態下,粗面內質網或糙面內質網(rough endoplasmic reticulum)可發生量和形態的改變。在蛋白質合成及分泌活性高的細胞(如漿細胞、胰腺腺泡細胞、肝細胞等)以及細胞再生和病毒感染時,粗面內質網增多。粗面內質網的含量高低也常反映腫瘤細胞的分化程度。相反,在萎縮的細胞(如飢餓時)以及有某種物質貯積的細胞,其粗面內質網則萎縮、減少。當細胞受損時,粗面內質網上的核糖體往往脫落於胞漿內,粗面內質網的蛋白合成會下降或消失;當損傷恢復時,其蛋白合成也隨之恢復。在由各種原因引起的細胞變性和壞死過程中,粗面內質網的扁囊一般出現擴張,較輕的和局限性的擴張只有在電子顯微鏡下才能窺見,重度擴張時則在光學顯微鏡下可表現為空泡形成,電子顯微鏡下有時可見其中含有中等電子密度的絮狀物。在較強的擴張時,粗面內質網同時互相離散,膜上的顆粒呈不同程度的脫失。進而內質網本身可斷裂成大小不等的片段和大小泡。這些改變大多見於細胞水腫時,故病變不僅見於內質網,也同時累及高基氏體、粒線體和細胞質基質,有時甚至還累及溶體。
平滑內質網
[編輯]光面內質網或滑面內質網(Smooth ER,縮寫:SER)的功能多種多樣,既參與肝糖的合成,又能合成磷脂、糖脂以及醣蛋白中的糖成分,此外,還在甾類化合物的合成中起重要的作用,故在合成甾類激素的細胞中特別豐富。光面內質網含有脫甲基酶、脫羧酶、去胺酶、葡糖醛酸酶以及混合功能氧化酶等,因而光面內質網能分解甾體、能滅活藥物和毒物並使其能被排除(如肝細胞)。腸上皮細胞的光面內質網參與脂肪的運輸,心肌細胞的光面內質網(肌漿網)則參與心肌的刺激傳導。在生理狀態下,隨著細胞功能的升降,光面內質網的數量也呈現相應改變。但亦可出現完全相反的情況,例如在某些疾病(如淤膽)時,從形態結構上看,肝細胞光面內質網顯著增生,但其混合功能氧化酶的活性反而下降,這實際上是細胞衰竭的表現。肝細胞的光面內質網具有生物轉化作用(biotransformation),能對一些低分子物質如藥物、毒品、毒物等,進行轉化解毒,並將間接膽紅素轉化為直接膽紅素。許多成癮藥物和嗜好品如巴比妥類藥物、毒品、酒等,可導致肝細胞光面內質網的增生,長期服用口服避孕藥、安眠藥、抗糖尿病藥等也能導致同樣後果。在B肝表面抗原陽性(B型肝炎)時,肝細胞內光面內質網明顯增生,在其管道內形成B肝表面抗原。由於光面內質網的大量增生,這種肝細胞在光學顯微鏡下呈毛玻璃外觀,故有毛玻璃細胞之稱,並可為地衣紅(orcein)著染。在細胞損傷時光面內質網也可出現小管裂解為小泡或擴大為大泡狀。在藥物及某些芳香族化合物(主為致癌劑)的影響下,光面內質網有時可在胞漿內形成蔥皮樣層狀結構,即「副核」,可為細胞的適應性反應(結構較松)或為變性性改變(結構緻密)。可在肝臟細胞協助解毒,在肌肉細胞貯存鈣離子。
肌質網
[編輯]肌質網(Sarcoplasmic Reticulum 縮寫SR)是平滑肌和橫紋肌細胞中的一種特化的平滑內質網,內部儲存了大量的鈣離子,和肌肉之收縮有關,見肌小節。
功能
[編輯]內質網具有許多一般功能,包括在稱為瀦泡的囊中摺疊蛋白質分子,以及將合成的蛋白質在囊泡中運輸到高基氏體。粗糙內質網也參與蛋白質合成。新合成蛋白質的正確摺疊是由幾種內質網分子伴侶蛋白實現的,包括蛋白質二硫鍵異構酶 (PDI)、ERp29、Hsp70家族成 BiP/Grp78、鈣聯結蛋白、鈣網蛋白和肽醯脯胺醯異構酶家族。只有正確摺疊的蛋白質才能從粗糙內質網運輸到高基氏體 - 未摺疊的蛋白質會引起未折疊蛋白反應,作為內質網中的應激反應。氧化還原反應調節、鈣調節、葡萄糖缺乏和病毒感染[2]或蛋白質過度表現[3]可導致內質網應激反應(ER應激),這是一種蛋白質摺疊減慢的狀態,導致未摺疊蛋白質增加。這種應激正在成為缺氧/缺血、胰島素抵抗和其他疾病的潛在損傷原因。[4]
參考文獻
[編輯]- ^ Porter KR, Claude A, Fullam EF. A study of tissue culture cells by electron microscopy. J Exp Med. March 1945, 81 (3): 233–246. PMC 2135493
 . PMID 19871454. doi:10.1084/jem.81.3.233 (英語).
. PMID 19871454. doi:10.1084/jem.81.3.233 (英語).
- ^ Xu C, Bailly-Maitre B, Reed JC. Endoplasmic reticulum stress: cell life and death decisions. The Journal of Clinical Investigation. October 2005, 115 (10): 2656–64. PMC 1236697
 . PMID 16200199. doi:10.1172/JCI26373.
. PMID 16200199. doi:10.1172/JCI26373.
- ^ Kober L, Zehe C, Bode J. Development of a novel ER stress based selection system for the isolation of highly productive clones. Biotechnology and Bioengineering. October 2012, 109 (10): 2599–611. PMID 22510960. S2CID 25858120. doi:10.1002/bit.24527.
- ^ Ozcan U, Cao Q, Yilmaz E, Lee AH, Iwakoshi NN, Ozdelen E, Tuncman G, Görgün C, Glimcher LH, Hotamisligil GS. Endoplasmic reticulum stress links obesity, insulin action, and type 2 diabetes. Science. October 2004, 306 (5695): 457–61. Bibcode:2004Sci...306..457O. PMID 15486293. S2CID 22517395. doi:10.1126/science.1103160.
