天冬氨酸蛋白酶
此條目翻譯品質不佳。 (2022年9月16日) |
| 真核天冬氨醯蛋白酶 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 鑑定 | |||||||||
| 標誌 | Asp | ||||||||
| Pfam | PF00026(舊版) | ||||||||
| InterPro | IPR001461 | ||||||||
| PROSITE | PDOC00128 | ||||||||
| SCOP | 1mpp / SUPFAM | ||||||||
| OPM家族 | 100 | ||||||||
| OPM蛋白 | 1lyb | ||||||||
| 膜蛋白資料庫 | 315 | ||||||||
| |||||||||
天冬氨酸蛋白酶 (英語:Aspartic protease)是一種催化類型的蛋白酶,它使用一個或多個天冬氨酸殘基結合的活化水分子來催化其肽底物。通常,它們在活性位點具有兩個高度保守的天冬氨酸,在酸性pH條件下具有最佳活性。幾乎所有已知的天冬氨醯蛋白酶都被胃酶抑素抑制。
天冬氨酸內肽酶EC 3.4.23已經表徵了脊椎動物、真菌和逆轉錄酶病毒的起源。[1]
真核天冬氨酸蛋白酶包括胃蛋白酶、組織蛋白酶和腎素。它們具有由祖先複製而產生的兩域結構。逆轉錄病毒和反轉錄轉座子蛋白酶(逆轉錄病毒天冬氨醯蛋白酶)比較小,並且似乎與真核天冬氨醯蛋白酶的單個結構域同源。每個結構域都提供一個催化天冬氨酸殘基,在分子的兩個葉之間有一個擴展的活性位點裂隙。很久以前,一個葉可能是通過基因複製從另一個進化而來的。在現代酶中,雖然三維結構非常相似,但除了保守的催化位點基序外,胺基酸序列的差異很大。二硫鍵的存在和位置是天冬氨酸肽酶的其他保守特徵。
催化機制
[編輯]
天冬氨醯蛋白酶是一個高度特異性的蛋白酶家族,它們傾向於切割具有疏水殘基和β-亞甲基的二肽鍵。與絲氨酸蛋白酶或半胱氨酸蛋白酶不同,這些蛋白酶在切割過程中不形成共價中間體。因此,蛋白水解是一步發生的。
儘管已經提出了許多不同的天冬氨醯蛋白酶機制,但最廣泛接受的是酸鹼機制,其原理是涉及水分子在兩個高度保守的天冬氨酸殘基之間的配位。天冬氨酸通過提取質子來活化水,使水能夠對底物易裂鍵的羰基碳進行親核攻擊,從而產生通過與第二天冬氨酸氫鍵穩定的四面體氧陰離子中間體。該中間體的重排導致易裂醯胺的質子化,這導致底物肽分裂成兩個產物肽。
抑制
[編輯]胃酶抑素是天冬氨酸蛋白酶的抑制劑。
分類
[編輯]已知有五個天冬氨酸蛋白酶超家族(氏族),每個都代表相同活性位點和機制的獨立進化。每個超家族包含幾個具有相似序列的家族。MEROPS分類系統按字母順序命名這些氏族。
前肽
[編輯]| A1_前肽 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
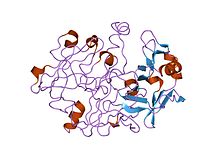 解析度為 1.62 埃的人前胃素的晶體和分子結構 | |||||||||
| 鑑定 | |||||||||
| 標誌 | A1_Propeptide | ||||||||
| Pfam | PF07966(舊版) | ||||||||
| InterPro | IPR012848 | ||||||||
| |||||||||
許多真核天冬氨酸內肽酶(MEROPS肽酶家族A1)是用信號肽和前肽合成的。動物胃蛋白酶樣內肽酶前肽形成了一個獨特的前肽家族,其中包含約30個殘基長的保守基序。在胃蛋白酶原A中,成熟胃蛋白酶序列的前11個殘基被前肽的殘基取代。前肽含有兩個螺旋,可阻斷活性位點裂隙,特別是胃蛋白酶中保守的天冬氨酸11殘基,在胃蛋白酶中,氫鍵與前肽中的保守Arg殘基結合。這種氫鍵穩定了前肽構象,並且可能負責在酸性條件下觸發胃蛋白酶原轉化為胃蛋白酶。
例子
[編輯]人類
[編輯]含有該結構域的人類蛋白質
[編輯]BACE1;BACE2;組織蛋白酶D;組織蛋白酶E;NAPSA;PGA5;PGC;腎素;
其他生物
[編輯]- HIV-1蛋白酶-治療愛滋病毒的主要藥物靶點
- Plasmepsin-在引起瘧疾的寄生蟲瘧原蟲中發現的一組天冬氨醯蛋白酶
參考
[編輯]- ^ Szecsi, P. B. The aspartic proteases. Scandinavian Journal of Clinical and Laboratory Investigation. 1992-01-01, 52 (sup210). ISSN 0036-5513. doi:10.1080/00365519209104650.
